
题目列表(包括答案和解析)
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为 。
(2)熔沸点:NH3 PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为 ,NCl3分子中中心原子的杂化方式为 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内 键和
键和 键的比为
。
键的比为
。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有 ,配位体为 。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为 。
在共价键中,如果电子对是由一个原子单方面提供而跟另一个原子共用的共价键叫配位键,如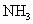 与酸反应时,氮原子上的电子对与
与酸反应时,氮原子上的电子对与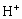 共用形成
共用形成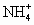 。下列物质中,同时具有离子键、共价键和配位键的是
。下列物质中,同时具有离子键、共价键和配位键的是
[ ]
A.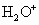 B.
B.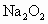 C.
C.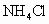 D.NaOH
D.NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com