
题目列表(包括答案和解析)


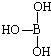 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:

(13分)
(1)A、B、C为短周期元素,请根据下表信息回答问题。
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
① 第一电离能:A B(填“>”、“<”或“=”), 基态C原子的电子排布式为 。
② B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为 。
(2)发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效
催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂
作用下合成甲醇(CH3OH),从而实现液化。
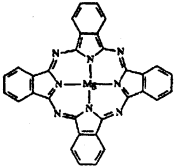
① 某含铜的离子结构如图所示:
在该离子内部微粒间作用力的类型有 。
a.离子键 b.极性键 c.非极性键
d.配位键 e.范德华力 f.氢键) (填字母)
② 煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键。请你说明甲醛分子间没有氢键原因 ;
③ 甲醇分子中进行sp3杂化的原子有 ;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为 。
(13分)
(1)A、B、C为短周期元素,请根据下表信息回答问题。
|
元素 |
A |
B |
C |
|
性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物的水溶液显碱性 |
原子有三个电子层,简单离子在本周期中半径最小 |
① 第一电离能:A B(填“>”、“<”或“=”), 基态C原子的电子排布式为 。
② B与C由共价键形成的某化合物BC最高可稳定到2200℃,晶体类型为 。
(2)发展煤的液化技术被纳入 “十二五”规划,中科院山西煤化所有关煤液化技术的高效
催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂
作用下合成甲醇(CH3OH),从而实现液化。

① 某含铜的离子结构如图所示:
在该离子内部微粒间作用力的类型有 。
a.离子键 b.极性键 c.非极性键
d.配位键 e.范德华力 f.氢键) (填字母)
② 煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键。请你说明甲醛分子间没有氢键原因 ;
③ 甲醇分子中进行sp3杂化的原子有 ;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为 。
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.| A-B | A=B | A≡B | ||
| CO | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ?mol-1) | 441.2 273 | |||
| N2 | 键能(kJ?mol-1) | 154.8 | 418.3 | 941.7 |
| 键能差值(kJ?mol-1) | 263.6 523.3 | |||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com