
题目列表(包括答案和解析)
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。

已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O、
、 。(写出其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个![]() 三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。
三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 。
(5)该工艺最大亮点是它符合下列原理 (填字母,下同)。
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 。
A.两种方案 B.三种方案 C.四种方案 D.五种方案
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: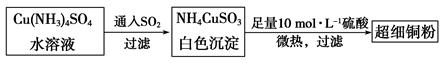
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②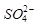 的空间构型为_____________,
的空间构型为_____________,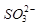 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 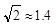 ,列式并计算结果)。
,列式并计算结果)。
(12分).氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为 ,其元素的第一电离能 B元素(填“>”或“<” 或“=”),原因是 。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为 ; BeCl2中Be原子的杂化轨道类型是 。
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是 ,阴离子的结构式为 。
(12分)氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为 ,其元素的第一电离能 B元素(填“>”或“<” 或“=”),原因是 。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为 ; BeCl2中Be原子的杂化轨道类型是 。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是 ,阴离子的结构式为 。
(12分)氯化铍是用于制有机铍化合物和金属铍的重要原料。
(1)BeCl2分子中组成元素Be的基态原子的价电子排布式为 ,其元素的第一电离能 B元素(填“>”或“<” 或“=”), 原因是 。
(2)已知BeCl2加热易升华,液态BeCl2不导电,BeCl2晶体类型为 ; BeCl2中Be原子的杂化轨道类型是 。
(3)用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子达到8电子稳定结构,则该离子内存在的微粒间的作用力是 ,阴离子的结构式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com