
题目列表(包括答案和解析)
(1)下列物质能导电的是 (填序号,下同),属于电解质的是 ,属于非电解质的是 。
①水银 ②CuSO4•5H2O ③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气
⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液
(2)按要求回答下列问题。
① Al2(SO4)3的电离方程式:
② NaHCO3的电离方程式:
③用化学方程式说明次氯酸钙粉末必须密封保存的原因:
④写出氯气与水反应的离子方程式:
(3)按要求完成下列填空:
①相同质量的氢气、甲烷、水,其中含分子数最多的是 。
②4.9 g H2SO4共含有 个原子。
③a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(1)下列物质能导电的是 (填序号,下同),属于电解质的是 ,属于非电解质的是 。
①水银 ②CuSO4?5H2O ③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气
⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液
(2)按要求回答下列问题。
①Al2(SO4)3的电离方程式:
② NaHCO3的电离方程式:
③用化学方程式说明次氯酸钙粉末必须密封保存的原因:
④写出氯气与水反应的离子方程式:
(3)按要求完成下列填空:
①相同质量的氢气、甲烷、水,其中含分子数最多的是 。
②4.9 g H2SO4共含有 个原子。
③a个X原子的总质量为b g,则X的相对原子质量可表示为________。
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?Lˉ1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
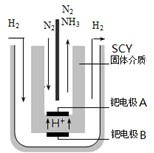


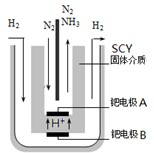
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

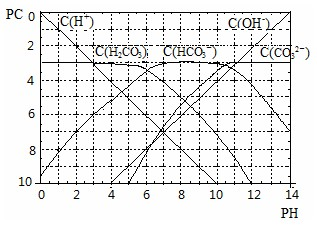
 H++HCO3ˉ 的电离平衡常数 ;
H++HCO3ˉ 的电离平衡常数 ; H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 .
H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 .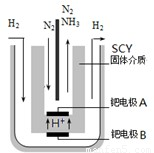
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为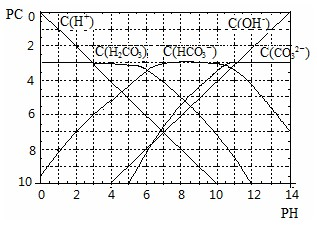
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com