
题目列表(包括答案和解析)
某研究性学习小组利用所学知识进行下列实验研究。请回答下列问题:
(1) 利用高锰酸钾分解制氧气,并测定高锰酸钾的质量分数。实验停止加热如图I所示(导管出口高于液面)。
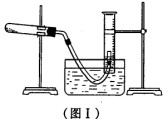
①测量收集到气体体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积。这三步操作的正
确顺序是:___________(请填写步骤代号)。
②测量收集到气体体积时,如何使量筒内外液面的高度相同?____________。
(2) 为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧
杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰。“过滤”中使用的玻璃仪
器是_____________________。
(3) 图Ⅱ是实验室制取TiCl4。的装置。四氯化钛是无色液体,沸点为1360C。它极
易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在
6500C~8500C下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体。
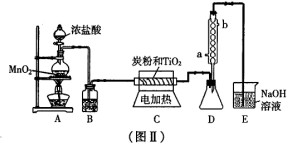
①A装置中反应的离子方程式______________________________
②B装置中的试剂及其作用是______________________________
③D装置中冷凝水的方向为_______________进_______________出。
④请指出此装置的缺陷和不妥之处

某研究性学习小组利用所学知识进行下列实验研究。请回答下列问题:
(1) 利用高锰酸钾分解制氧气,并测定高锰酸钾的质量分数。实验停止加热如图I所示(导管出口高于液面)。
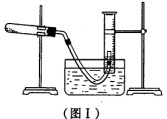
①测量收集到气体体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积。这三步操作的正
确顺序是:___________(请填写步骤代号)。
②测量收集到气体体积时,如何使量筒内外液面的高度相同?____________。
(2) 为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧
杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰。“过滤”中使用的玻璃仪
器是_____________________。
(3) 图Ⅱ是实验室制取TiCl4。的装置。四氯化钛是无色液体,沸点为1360C。它极
易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在
6500C~8500C下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体。
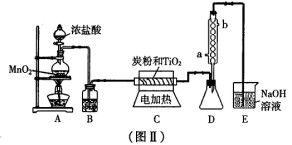
①A装置中反应的离子方程式______________________________
②B装置中的试剂及其作用是______________________________
③D装置中冷凝水的方向为_______________进_______________出。
④请指出此装置的缺陷和不妥之处

(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
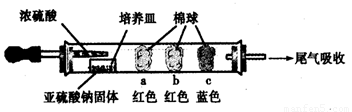
|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: |
|
c |
|
棉球变为白色 |
该气体具有 (选填“氧化性”或“还原性”) |
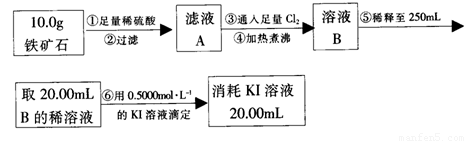
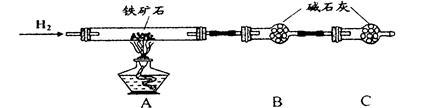
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
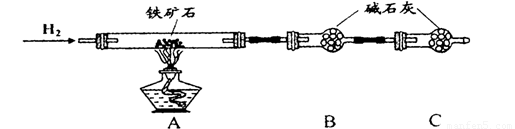
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
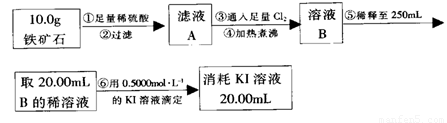
(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:

|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式:
|
|
c |
|
棉球变为白色 |
结论:该气体具有 性 |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
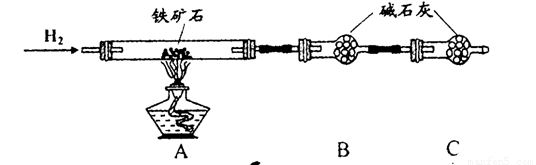
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)步骤c中填空
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。实验二:铁矿石中含铁量的测定
(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤②和⑤中都要用到的玻璃仪器是______ __。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成
(6)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。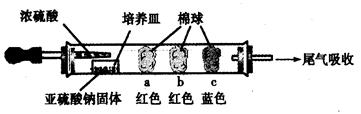
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 该气体具有 (选填“氧化性”或“还原性”) |

第Ⅰ卷(选择题,共63分)
一二.选择题。(3’×9+4’×9)
题号
1
2
3
4
5
6
7
8
9
答案
A
C
D
B
D
C
B
B
C
题号
10
11
12
13
14
15
16
17
18
答案
D
AC
B
AC
BC
B
C
CD
A
第Ⅱ卷(非选择题,共83分)
三.(本题包括3小题,共32分)
19.(9分)(1)双氧水(1分),Na2O2(其它合理答案也可)(1分)(2)a(1分)
(3)吸收多余氯气,防止污染空气。(2分)
(4)洗气瓶.安全瓶(其它合理答案也可)(各2分,共4分)
20.(11分)(1)固体完全溶解,溶液呈血红色(2分) (2)ABC(3分)
(3) Fe2O3+6H+===2Fe3++3H2O Cu2O+2H+===Cu+Cu2++H2O 2Fe3++Cu===2Fe2++Cu2+(每个离子方程式2分,共6分)
21.(12分)(1)B.锌粒(1分) C.水(1分) D.浓硫酸(1分)
(2)检查气密性(1分) 将G弯管浸没在盛有水的烧杯中,关闭分液漏斗活塞,温热烧瓶B,观察G管口,若有气泡逸出,停止加热后,G管倒吸形成一段水柱,说明装置的气密性良好(2分)(3)先从A瓶逐滴滴加液体(1分) 检验H2的纯度(1分)
(4)氢气(1分) 在G管出口处点燃(1分)
(5)
 或
或  (2分)
(2分)
四.(本题包括3小题,共31分)
22.(8分)(1)14HNO3+3Cu2O = 6Cu(NO3)2+2NO↑+7H2O。(2分) (2)酸性;氧化性(2分) (3)0.6 mol(2分) (4)使用了较浓的硝酸,产物中有部分二氧化氮生成。(2分)
 23.(14分)(1)2Na+2H2O=2Na++2OH-+H2↑ (2分) (2)酸(1分) NH4++H2O
23.(14分)(1)2Na+2H2O=2Na++2OH-+H2↑ (2分) (2)酸(1分) NH4++H2O NH3?H2O+H+ (2分)
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3KJ/mol (2分)
(4)I.NO2(2分)Ⅱ.b (1分) Ⅲ.0.8(或0.8mol/L) (2分) Ⅳ.增大NO2的浓度(合理均可)(2分)
NH3?H2O+H+ (2分)
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3KJ/mol (2分)
(4)I.NO2(2分)Ⅱ.b (1分) Ⅲ.0.8(或0.8mol/L) (2分) Ⅳ.增大NO2的浓度(合理均可)(2分)
24.(9分)(1)
(2)氧化.2Cl-+2e-=Cl2↑;
CaCl2+2H2O=Ca(OH)2+Cl2↑+H2↑;
(3)①F极放出黄绿色气体,E极放出无色气体;
②E极附近溶液变为红色;
③溶液变浑浊
五.(本题包括1小题,共10分)
25.(10分)29.(1) E F(2分)(2) ①③(2分)
 (3)A.CH3CH=CH2 ,
I.
(3)A.CH3CH=CH2 ,
I. 。(4分)
。(4分)
(4)(2分)
六.(本题包括2小题,共10分,任意选做一题,如果两道题都做,则按第26题给分)
26.⑴酯基.碳碳双键.苯环(3分)⑵加成(加聚)(2分)⑶(3分)
|