
题目列表(包括答案和解析)
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为 。
(2)熔沸点:NH3 PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为 ,NCl3分子中中心原子的杂化方式为 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内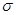 键和
键和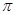 键的比为
。
键的比为
。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有 ,配位体为 。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为 。
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为 。
(2)熔沸点:NH3 PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为 ,NCl3分子中中心原子的杂化方式为 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内键和
键的比为 。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有 ,配位体为 。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为 。
 经催化剂作用变成N2和CO
经催化剂作用变成N2和CO 2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内
2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内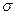 键和
键和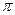 键的比为 。
键的比为 。| A.氢键 | B.离子键 | C.共价键 | D.配位键[E.范德华力 |
 对,则[Cu(NH3)n]+中n的值为
对,则[Cu(NH3)n]+中n的值为  。
。(9分) 超硬材料氮化铂是近年来的一个研究热点。它是在高温、超高压条件下合成的(50GPa、2000K)。由于相对于铂,氮原子的电子太少,衍射强度太弱,单靠X-射线衍射实验难以确定氮化铂晶体中氮原子数和原子坐标,2004年以来,先后提出过氮化铂的晶体结构有闪锌矿型、岩盐型(NaCl)和萤石型,2006年4月11日又有人认为氮化铂的晶胞如下图所示(图中的白球表示氮原子,为便于观察,该图省略了一些氮原子)。结构分析证实,氮是四配位的,而铂是六配位的;Pt―N键长均为209.6pm,N―N键长均为142.0 pm(对比:N2分子的键长为110.0pm)。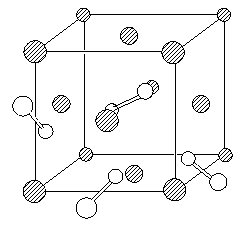 备用图
备用图
8-1 氮化铂的上述四种立方晶体在结构上有什么共同点?
8-2 分别给出上述四种氮化铂结构的化学式。
8-3 试在图上挑选一个氮原子,不添加原子,用粗线画出所选氮原子的配位多面体。
8-4请在本题的附图上添加六个氮原子(添加的氮请尽可能靠前)。
第Ⅰ卷(选择题,共63分)
一二.选择题。(3’×9+4’×9)
题号
1
2
3
4
5
6
7
8
9
答案
A
C
D
B
D
C
B
B
C
题号
10
11
12
13
14
15
16
17
18
答案
D
AC
B
AC
BC
B
C
CD
A
第Ⅱ卷(非选择题,共83分)
三.(本题包括3小题,共32分)
19.(9分)(1)双氧水(1分),Na2O2(其它合理答案也可)(1分)(2)a(1分)
(3)吸收多余氯气,防止污染空气。(2分)
(4)洗气瓶.安全瓶(其它合理答案也可)(各2分,共4分)
20.(11分)(1)固体完全溶解,溶液呈血红色(2分) (2)ABC(3分)
(3) Fe2O3+6H+===2Fe3++3H2O Cu2O+2H+===Cu+Cu2++H2O 2Fe3++Cu===2Fe2++Cu2+(每个离子方程式2分,共6分)
21.(12分)(1)B.锌粒(1分) C.水(1分) D.浓硫酸(1分)
(2)检查气密性(1分) 将G弯管浸没在盛有水的烧杯中,关闭分液漏斗活塞,温热烧瓶B,观察G管口,若有气泡逸出,停止加热后,G管倒吸形成一段水柱,说明装置的气密性良好(2分)(3)先从A瓶逐滴滴加液体(1分) 检验H2的纯度(1分)
(4)氢气(1分) 在G管出口处点燃(1分)
(5)
 或
或  (2分)
(2分)
四.(本题包括3小题,共31分)
22.(8分)(1)14HNO3+3Cu2O = 6Cu(NO3)2+2NO↑+7H2O。(2分) (2)酸性;氧化性(2分) (3)0.6 mol(2分) (4)使用了较浓的硝酸,产物中有部分二氧化氮生成。(2分)
 23.(14分)(1)2Na+2H2O=2Na++2OH-+H2↑ (2分) (2)酸(1分) NH4++H2O
23.(14分)(1)2Na+2H2O=2Na++2OH-+H2↑ (2分) (2)酸(1分) NH4++H2O NH3?H2O+H+ (2分)
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3KJ/mol (2分)
(4)I.NO2(2分)Ⅱ.b (1分) Ⅲ.0.8(或0.8mol/L) (2分) Ⅳ.增大NO2的浓度(合理均可)(2分)
NH3?H2O+H+ (2分)
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3KJ/mol (2分)
(4)I.NO2(2分)Ⅱ.b (1分) Ⅲ.0.8(或0.8mol/L) (2分) Ⅳ.增大NO2的浓度(合理均可)(2分)
24.(9分)(1)
(2)氧化.2Cl-+2e-=Cl2↑;
CaCl2+2H2O=Ca(OH)2+Cl2↑+H2↑;
(3)①F极放出黄绿色气体,E极放出无色气体;
②E极附近溶液变为红色;
③溶液变浑浊
五.(本题包括1小题,共10分)
25.(10分)29.(1) E F(2分)(2) ①③(2分)
 (3)A.CH3CH=CH2 ,
I.
(3)A.CH3CH=CH2 ,
I. 。(4分)
。(4分)
(4)(2分)
六.(本题包括2小题,共10分,任意选做一题,如果两道题都做,则按第26题给分)
26.⑴酯基.碳碳双键.苯环(3分)⑵加成(加聚)(2分)⑶(3分)
|