
题目列表(包括答案和解析)
(8分)天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH="=" -889.6kJ/mol
请回答下列问题:
(1)反应物能量总和________(填“大于”、“小于”或“等于”)生成物能量总和。
(2)若1 mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量 (填“>”、“<”或“=”)889.6kJ。
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l) ΔH =-572kJ/mol ,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________。
(4)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池,利用该装置可以将 能转化为 能。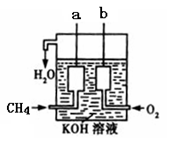
(8分)天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH== -889.6kJ/mol
请回答下列问题:
(1)反应物能量总和________(填“大于”、“小于”或“等于”)生成物能量总和。
(2)若1 mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量 (填“>”、“<”或“=”)889.6kJ。
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l) ΔH =-572kJ/mol ,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________。
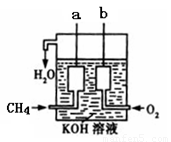
(4)如图所示的装置是由CH4 、O2和KOH溶液组成的新型燃料电池,利用该装置可以将 能转化为 能。
(9分)“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式:_____________________ ,
若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量_______890 kJ(填“>”、“=”或“<”)。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为_______;燃烧生成的CO2的质量比约为_______。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是___________。
(9分)“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式:_____________________ ,
若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量_______890 kJ(填“>”、“=”或“<”)。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为_______;燃烧生成的CO2的质量比约为_______。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com