(2011?江西)0.80gCuSO
4?5H
2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
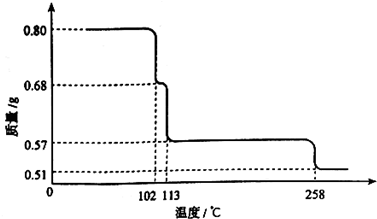
请回答下列问题:
(1)试确定200℃时固体物质的化学式
CuSO4?H2O
CuSO4?H2O
(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为
.把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为
CuSO4?5H2O
CuSO4?5H2O
,其存在的最高温度是
102℃
102℃
;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为
2H
2SO
4(浓)+Cu
CuSO
4+SO
2↑+2H
2O
2H
2SO
4(浓)+Cu
CuSO
4+SO
2↑+2H
2O
;
(4)在0.10mol?L
-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu
2+)=
2.2×10-8
2.2×10-8
mol?L
-1(K
sp[Cu(OH)
2]=2.2×10
-20).若在0.1mol?L
-1硫酸铜溶液中通入过量H
2S气体,使Cu
2+完全沉淀为CuS,此时溶液中的H
+浓度是
0.2
0.2
mol?L
-1.

 动(填“向左”、“向右”或“不”).
动(填“向左”、“向右”或“不”).