
题目列表(包括答案和解析)
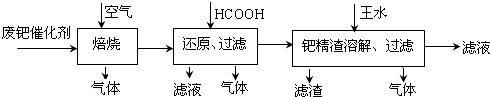
|
工业上用氨的催化氧化法制HNO3时,先制得50%左右的硝酸,然后再制成96%的浓HNO3,一般采用的方法是 | |
| [ ] | |
A. |
加CaCl2后再蒸馏浓缩 |
B. |
加生石灰吸去水分后再过滤 |
C. |
加硝酸镁后再蒸馏浓缩 |
D. |
加入浓H2SO4后再分液 |
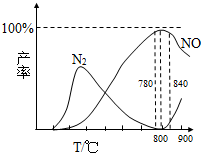
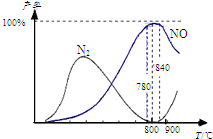 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( )
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com