
题目列表(包括答案和解析)
A.若a∶b>1∶2,生成S和SO2 B.若a∶b=1∶2,生成S而无SO2
C.若a∶b<1∶2,生成S和H2S D.若a∶b≤1∶3,生成S、H2S和SO2
|
将含有a mol Na2SO3的溶液和含有b mol Na2S的溶液混合后无明显现象.若再加入稀H2SO4,则立即出现浅黄色硫沉淀.下列叙述不正确的是 | |
| [ ] | |
A. |
若a∶b>1∶2,生成S和SO2 |
B. |
若a∶b=1∶2,生成S而无SO2 |
C. |
若a∶b<1∶2,生成S和H2S |
D. |
若a∶b≤1∶3,生成S、H2S和SO2 |
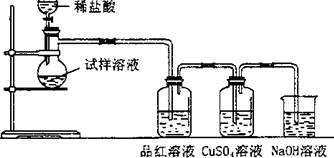 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)| A、K1+K2 | ||
| B、K1-K2 | ||
C、
| ||
D、
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com