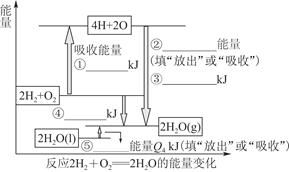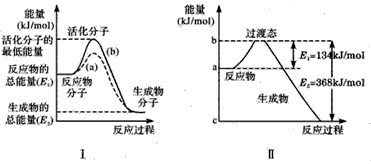
化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.
(1)许多化学反应的反应热可以直接测量,测量仪器叫做
量热计
量热计
.
(2)下列△H表示物质燃烧热的是
△H4、△H5
△H4、△H5
(填序号);表示中和热的是
△H6
△H6
(填“△H
1、△H
2、或△H
3”等).
A.2H
2(g)+O
2(g)═2H
2O(l);△H
1B.C(s)+
O
2(g)═CO(g);△H
2C.CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(l);△H
3D.C(s)+O
2(g)═CO
2(g);△H
4E.C
6H
12O
6(s)+6O
2(g)═6CO
2(g)+6H
2O(l);△H
5F.NaOH(ag)+HCl(ag)═NaCl(ag)+H
2O(l);△H
6G.2NaOH(ag)+H
2SO
4(ag)═Na
2SO
4(ag)+2H
2O(l);△H
7(3)已知15g乙烷完全燃烧生成CO
2和液态水,放热a kJ,下列热化学方程式正确是
C
C
.
A.C
2H
6(g)+
O
2(g)═2CO
2(g)+3H
2O(l);△H
1=+2a kJ/mol
B.C
2H
6(g)+
O
2(g)═2CO
2(g)+3H
2O(g);△H
2=-2a kJ/mol
C.2C
2H
6(g)+7O
2(g)═4CO
2(g)+6H
2O(l);△H
3=-4a kJ/mol
D.2C
2H
6(g)+7O
2(g)═4CO
2(g)+6H
2O(g);△H
4=-2a kJ/mol
(4)充分燃烧一定丁烷放出热量161.9kJ,生成的CO
2恰好与5mol/L 100mL KOH溶液完全反应生成正盐,则燃烧1mol丁烷放出能量为
2590.4kJ
2590.4kJ
.
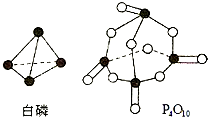
(5)进一步研究表明,化学反应能量变化与键能有关.键能简单理解断开1mol化学键吸收能量.下表是键能数据:
| 化学键 |
P-P |
P-O |
O=O |
P=O |
| 键能(kJ/mol) |
197 |
360 |
499 |
X |
已知白磷燃烧热为2378.0kJ/mol,则X=
433.75
433.75
.

 化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.
化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.