
题目列表(包括答案和解析)
![]() (Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)![]() 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
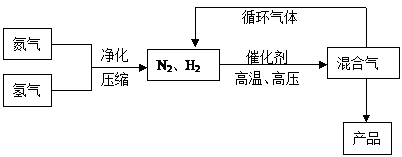 |
![]()
![]()
![]()
![]()
![]()
![]() 回答下列问题:
回答下列问题:
![]() ⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
![]() 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
![]() 2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
![]() 则N2(g)+3H2(g)
则N2(g)+3H2(g)![]() 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。![]()
![]()
![]()
![]() (2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ, 写出表示N2H4燃烧热的热化学方程式是 。
写出表示N2H4燃烧热的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
|
负极的电极反应式 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,
铜片的质量变化128g,则肼一空气燃料电池理论
上消耗标准状况下的空气 L
(假设空气中氧气体积含量为20%)
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)![]() 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:

回答下列问题:
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ,写出表示N2H4燃烧热的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式 。
(3)图是一个电化学过程示意图。
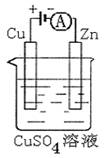
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
 (2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放. 4NO(g)+6H2O(g)
4NO(g)+6H2O(g) 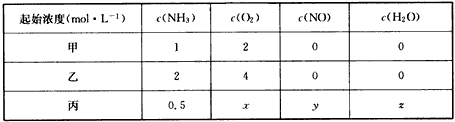
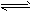 N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和
N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和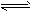 4NO(g)+6H2O(g)
4NO(g)+6H2O(g) 
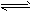 N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和
N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com