
题目列表(包括答案和解析)
常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是
A.pH = 3的二元弱酸H2R溶液与pH = 11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c ( R2+ ) + c ( HR- ) = c ( Na+ )
B.某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:
c ( Cl- ) > c ( NH4+ ) > c ( H+ ) = c ( OH- )
C.某物质的溶液中由水电离出的c ( H+ ) = 1×10-a mol·L-1,若a > 7,则溶液的pH一定为14 - a
D.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2c( OH- ) + c( A- ) =2c( H+ ) + c( HA )
常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是
A.pH = 3的二元弱酸H2R溶液与pH = 11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c ( R2+ ) + c ( HR-) = c ( Na+ )
B.某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:
c ( Cl- ) > c ( NH4+) > c ( H+ ) = c ( OH- )
C.某物质的溶液中由水电离出的c ( H+ ) = 1×10-a mol·L-1,若a > 7,则溶液的pH一定为14 - a
D.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2c( OH- ) + c( A- ) =2c( H+ ) + c( HA )
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —Q1 kJ·mol-1
2SO3(g) ΔH= —Q1 kJ·mol-1
2NO(g) + O2(g)![]() 2NO2(g) ΔH= —Q2kJ·mol-1
2NO2(g) ΔH= —Q2kJ·mol-1
则反应NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= kJ·mol-1。
SO3(g) + NO(g) 的ΔH= kJ·mol-1。
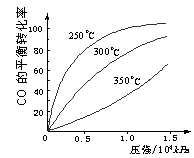 (2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
上述反应, 当测得上述反应平衡时NO2与NO体积比为1:3,
则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的
CH3OH(g)。CO在不同温度下的
平衡转化率与压强的关系如下图所示。该反应ΔH 0
(填“>”或“ <”)。
Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释Na2C2O4溶液显碱性的原因 ;
(2)常温下,比较0.1 mol·L-1NaHC2O4溶液中各种离子浓度的大小关系 ;
Ⅲ.某课外活动小组为了探究的BaSO4溶解度,分别将足量BaSO4放入:a. 5ml 水;b. 40 ml 0.2 mol·L-1的Ba(OH)2溶液;c. 20ml 0.5 mol·L-1的Na2SO4溶液;d. 40ml 0.1 mol·L-1的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,的浓度由大到小的顺序为 ;
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同学取同样的溶液b和溶液d直接混合,则混合溶液的pH值为 (设混合溶液的体积为混合前两溶液的体积之和)。
一、选择题
生物1―5ABCDB
化学6―13CDABCDBC
物理
14.B 15.C 16.CD 17.AD 18.A 19.B 20.AB 21.A
二、非选择题
22.I.(1)100.2
(2)a (3)0.30, 9.86
|