
题目列表(包括答案和解析)
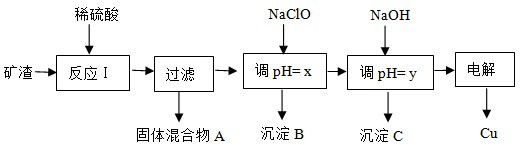
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(8分)类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期律完成下列问题:
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 |
| 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 |
|
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)硒的熔点范围可能是 。
(2)碲的化合价可能有 。
(3)氢硒酸有较强的还原性。因此放在空气中长期保存易变质,其可能发生的化学方程式为:
。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
Al2Te3+ →Al(OH)3↓+ H2Te↑
(8分)在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸, 所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。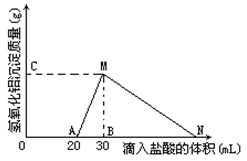
问:
(1)此溶液中同时含有____mol___ 离子;
(2)用离子方程式表示MN段发生的反应是
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)=
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为 mL
(8分)请回答下列各问:
(1)酸雨的pH范围是 ,在空气质量报告的各项指标中有可吸入颗粒物,还有 。
(2)石灰法是目前应用最广泛的工业废气脱硫方法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂在吸收塔中与废气中的SO2反应而将硫固定,写出反应的化学方程式 。
(3)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu CuO
Cu(NO3)2
(4)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.40.32L B.30.24L C.20.16L D.13.44L
(5)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
(8分) 将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72L。
(1)写出与碱反应涉及的化学方程式:_____________________________________
(2)混合物中Al和Fe的质量分别为________和__________
(3)当混合物与盐酸反应时,转移电子数为_______mol;与NaOH溶液反应时转移电子
数为_______mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com