合成氨对化学工业和国防工业具有重要意义.
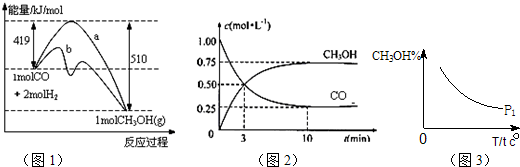
(1)向合成塔中按物质的量之比l:4充入N
2、H
2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图.
①图A中氨气的体积分数为15%时,H
2的转化率为
24.46%
24.46%
.
②图B中T=450℃,则温度为500℃时对应的曲线是
a
a
(填“a”或“b”).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H>0,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
| 时间/min |
CH4(mol) |
H2O(mol) |
CO(mol) |
H2(mol) |
| 0 |
0.40 |
1.00 |
0 |
0 |
| 5 |
x1 |
0.80 |
x2 |
0.60 |
| 7 |
0.20 |
y1 |
0.20 |
y2 |
| 10 |
0.21 |
0.81 |
0.19 |
0.64 |
①分析表中数据,判断5min时反应是否处于平衡状态?
是
是
(填“是”或“否”),前5min反应的平均反应速率v(CH
4)=
0.02mol?L-1?min-1
0.02mol?L-1?min-1
.
②该温度下,上述反应的平衡常数K=
0.0675
0.0675
.
③反应在7~10min内,CO的物质的量减少的原因可能是
d
d
(填字母).
a.减少CH
4的物质的量 b.降低温度 c.升高温度 d.充入H
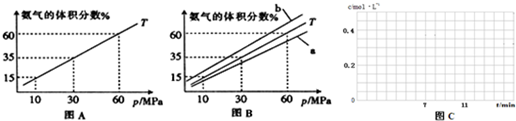
2④若第7分钟时将容器压缩至1L,请在图C所示坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线.

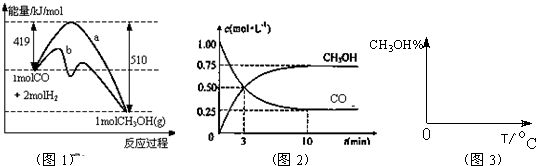
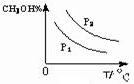
 CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.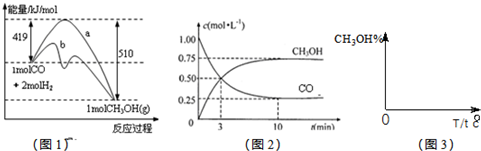
 CH3OH(g)的平衡常数为
CH3OH(g)的平衡常数为