
题目列表(包括答案和解析)

(1)若以A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则此时水的离子积从___________变到_____________,造成水的离子积变化的原因是__________________________________________。
(2)已知25℃时,0.1 L 0.1mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为__________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为____________。
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是_____________________。

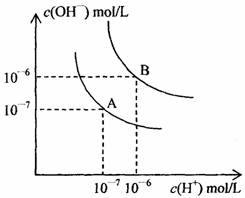
水的电离平衡曲线如下图所示:
(1)若以A点表示25℃时水的电离平衡时的离子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从_______增加到______。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积之比为______。
(3)已知AnBm的离子积可表示为[c(Am+)]n×[c(Bn-)]m,式中c(Am+)、c(Bn-)表示离子的物质的量浓度。若某温度下Ca(OH)2的溶解度为0.74g,其饱和溶液的密度为1g?mL-1,其离子积约为_______。
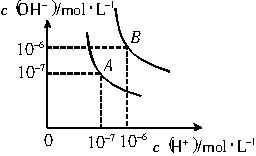
水的电离平衡曲线如下图所示:
①若以A点表示25℃时水的电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。造成水的离子积增大的原因是 。
②100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液和硫酸溶液的体积比为 ,此溶液中各种离子浓度由大到小排列的顺序是 。
水的电离平衡曲线如下图所示:
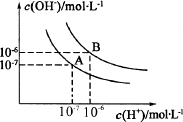
(1)若以A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则此时水的离子积从________变到________,造成水的离子积变化的原因是________.
(2)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为________.
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为________.
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com