
题目列表(包括答案和解析)
 Ⅰ右图为A、B、C三种物质的溶解度曲线,据图回答:
Ⅰ右图为A、B、C三种物质的溶解度曲线,据图回答:| 1 H 氢 |
2 He 氦 | ||||||
| 3 Li 锂 |
4 Be 铍 |
5 B 硼 |
6 C 碳 |
7 N 氮 |
8 O 氧 |
9 F 氟 |
10 Ne 氖 |
| 11 Na 钠 |
12 Mg 镁 |
13 Al 铝 |
14 Si 硅 |
15 P 磷 |
16 S 硫 |
17 Cl 氯 |
18 Ar 氩 |
 ,该粒子所属元素位于周期表的第
,该粒子所属元素位于周期表的第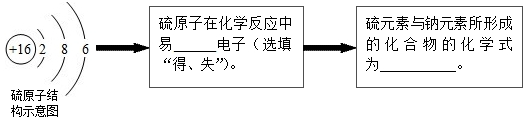
以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验序号 | 过氧化氢溶液浓度、% | 过氧化氢溶液体积/ml | 温度/C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | 2 | 49.21 | |
| 4 | 30 | 5 | 55 | 2 | 10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;从实验③和④对比可知,化学反应速率与温度的关系是 ;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是 .
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量 (选填“减小”或“不变”或“增大”).
以下是某研究小组探究影响反应速率部分因素的相关实验数据.
|
实验序号 |
过氧化氢溶液浓度、% |
过氧化氢溶液体积/ml |
温度/C |
二氧化锰的用量/g |
收集氧气的体积/ml |
反应所需的时间/s |
|
1 |
5 |
1 |
20 |
0.1 |
4 |
16.74 |
|
2 |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
|
3 |
30 |
5 |
35 |
|
2 |
49.21 |
|
4 |
30 |
5 |
55 |
|
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;从实验③和④对比可知,化学反应速率与温度的关系是 ;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量 (选填“减小”或“不变”或“增大”).
A.50 mL 50 g B.45.5 mL 50 g
C.55 mL 40.5 g D.45.5 mL 54.5 g
配制100 g 10%的盐酸,需要20%的盐酸(密度是1.1 g/cm3)的体积与水的质量分别是
A.55 mL 50 g
B.45.5 mL 50 g
C.55 mL 40.5 g
D.45.5 mL 54.5 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com