
题目列表(包括答案和解析)
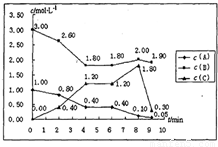
| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(Ⅰ)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
(1)图中A表示 。
(2)E的大小对该反应的焓变有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? 。
(3)某温度下,向1L密闭容器中开始充入2molSO2和1molO2,在V2O5催化剂存在时反应达到平衡,压强减小为开始时的 ;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)
;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)  2SO2(g) + O2(g)的平衡常数(写出计算过程)
2SO2(g) + O2(g)的平衡常数(写出计算过程)
(Ⅱ)化学试剂的生产和电镀工业排放的废水中常含有20~100mg.L-1Cr(Ⅵ),饮用含Cr(Ⅵ)的水会损害人的肠胃等,已知Cr(Ⅲ)的毒性是Cr(Ⅵ)的0.5%,国家规定工业废水含Cr(Ⅵ)的量排放标准为0.1mg.L-1。工业上常用化学法和电解法处理含Cr(Ⅵ)废水,再将Cr(Ⅲ)转化成沉淀除去,某研究性学习小组为研究废水的净化,设计了如下实验流程:
(1)配平第①步反应的离子方程式:
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)设计一个电解装置也可以实现上述目的,装置如下图(用铁棒和石墨作电极):
电极材料:c为:
电极反应:d极:
(Ⅰ)2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:

(1)图中A表示 。
(2)E的大小对该反应的焓变有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? 。
(3)某温度下,向1L密闭容器中开始充入2molSO2和1molO2,在V2O5催化剂存在时反应达到平衡,压强减小为开始时的![]() ;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)
;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g) ![]() 2SO2 (g) + O2(g)的平衡常数(写出计算过程)
2SO2 (g) + O2(g)的平衡常数(写出计算过程)
(Ⅱ)化学试剂的生产和电镀工业排放的废水中常含有20~100mg.L-1Cr(Ⅵ),饮用含Cr(Ⅵ)的水会损害人的肠胃等,已知Cr(Ⅲ)的毒性是Cr(Ⅵ)的0.5%,国家规定工业废水含Cr(Ⅵ)的量排放标准为0.1mg.L-1。工业上常用化学法和电解法处理含Cr(Ⅵ)废水,再将Cr(Ⅲ)转化成沉淀除去,某研究性学习小组为研究废水的净化,设计了如下实验流程:

(1)配平第①步反应的离子方程式:
![]()
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)设计一个电解装置也可以实现上述目的,装置如下图(用铁棒和石墨作电极):

电极材料:c为:
电极反应:d极:
(15分)为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。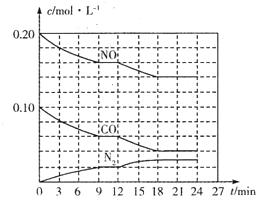
①CO在0-9min内的平均反应速率v(CO)=________mol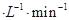 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
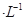 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com