
题目列表(包括答案和解析)
 I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下: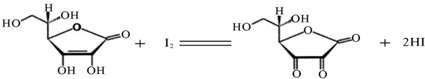


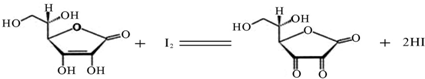

(10分)维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定。维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I–![]() I3–,故标准I2溶液应配成I2的KI溶液)进行滴,原理如下:
I3–,故标准I2溶液应配成I2的KI溶液)进行滴,原理如下:

(1)滴定过程中应选用 (填酸式或碱式)滴定管盛放标准I2溶液,滴定所用的指示剂为 ,出现 现象时即为滴定终点。
(2)待测维生素C溶液在配制过程中,可以加入下列试剂中的 (填字母)
 A.0.1 mol·L-1 CH3COOH B.0.1 mol·L-1 HNO3
A.0.1 mol·L-1 CH3COOH B.0.1 mol·L-1 HNO3
C.0.1 mol·L-1 NaOH D.0.1 mol·L-1 Na2SO3
(3)配制一定物质的量浓度的标准I2溶液所需玻璃仪器有 (填字母)
A.容量瓶 B.胶头滴管 C.玻璃棒 D.烧杯 E.量筒
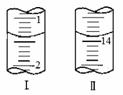
(4)将1.0 g 维生素样品制成100 mL溶液,取25 mL用0.1 mol·L-1的I2溶液滴定,滴定前后滴定管中示数如图,则样品中维生素C的质量分数为 。
 I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3-,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:

维生素C又称抗坏血酸,广泛存在于水果、蔬菜中,属于外源性维生素,人体不能自身合成,必须从食物中摄取。其化学式为C6H8O6,相对分子量为176.1,由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,半反应为:
C6H8O6=C6H6O6+2H++2e j y =0.18V
因此,可以采用碘量法测定维生素C药片中抗坏血酸的含量。具体实验步骤及结果如下:
(1)准确移取0.01667mol/L的K2Cr2O7标准溶液10.00mL于碘量瓶中,加3mol/L H2SO4溶液10mL,10% KI溶液10mL,塞上瓶塞,暗处放置反应5min,加入100mL水稀释,用Na2S2O3标准溶液滴定至淡黄色时,加入2mL淀粉溶液,继续滴定至溶液由蓝色变为亮绿色。平行三次实验,消耗Na2S2O3标准溶液平均体积为19.76mL。
(2)准确移取上述Na2S2O3标准溶液10.00mL于锥瓶中,加水50mL,淀粉溶液2mL,用I2标准溶液滴定至蓝色且30s不褪。平行三次实验,消耗I2标准溶液平均体积为10.15mL。
(3)准确称取0.2205g的维生素C粉末(维生素C药片研细所得)于锥瓶中,加新煮沸过并冷却的蒸馏水100mL,2 mol/L HAc溶液10mL,淀粉溶液2mL,立即用I2标准溶液滴定至蓝色且30s不褪,消耗12.50mL。
(4)重复操作步骤(3),称取维生素C粉末0.2176g,消耗I2标准溶液为12.36mL;称取维生素C粉末0.2332g,消耗I2标准溶液为13.21mL。
根据以上实验结果计算出该维生素C药片中所含抗坏血酸的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com