
题目列表(包括答案和解析)
(7分)Ⅰ、下列说法不正确的是 。
A.用100mL的容量瓶准确量取100mL液体
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里
D.用加热的方法提取NH4C1固体中的少量碘单质
E.浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处
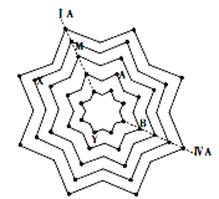
Ⅱ、某同学在学习元素周期表后,将第二至第六周期的主族和零族元素排列成“八角星”元素周期表(如图),图中每个“·”代表一种元素,每个“八角星”代表一个周期,元素X核外有5个电子层。试写出M的元素符号是 ,元素Y的原子结构示意图为 。
(7分)Ⅰ、下列说法不正确的是 。
A.用100mL的容量瓶准确量取100mL液体
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里
D.用加热的方法提取NH4C1固体中的少量碘单质
E.浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处
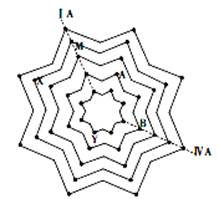
Ⅱ、某同学在学习元素周期表后,将第二至第六周期的主族和零族元素排列成“八角星”元素周期表(如图),图中每个“·”代表一种元素,每个“八角星”代表一个周期,元素X核外有5个电子层。试写出M的元素符号是 ,元素Y的原子结构示意图为 。
(7分)Ⅰ、下列说法不正确的是 。
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体中的少量碘单质 |
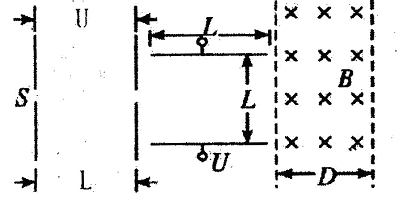
A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g)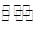 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)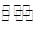 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
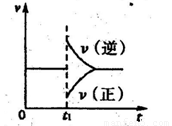
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中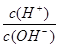 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g)2Y(g),其化学平衡常数K与T的关系如下表所示:
| T/℃ | 300 | 400 |
| K | 3.41 | 0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com