
题目列表(包括答案和解析)
| A、常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① | B、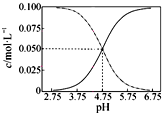 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | C、向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-→CO32-+CaCO3↓+2H2O | D、25℃时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系:Kw?K=Ka |
| A、按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的名称是:2-甲基-3-丙基戊烷 | B、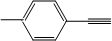 分子中所有原子共平面 分子中所有原子共平面 | C、某蔗糖酯可以由蔗糖与硬脂酸乙酯合成,反应如下: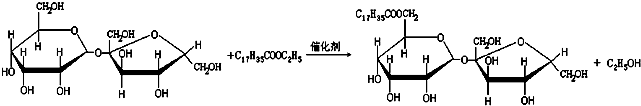 该蔗糖酯在稀硫酸的作用下水解能得到三种有机产物 | D、荧光黄的结构简式为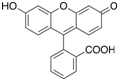 ,其分子式为C20H12O5,理论上1mol该有机物最多消耗2mol NaOH,并能与双缩脲试剂发生显色反应 ,其分子式为C20H12O5,理论上1mol该有机物最多消耗2mol NaOH,并能与双缩脲试剂发生显色反应 |

 的溶液中:Al3+、NH4+、Cl-、CO32-
的溶液中:Al3+、NH4+、Cl-、CO32- 
| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com