
题目列表(包括答案和解析)
| 催化剂 |
| △ |
| ||
| ||
| ||
| ||
| 催化剂 |
| △ |
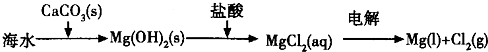
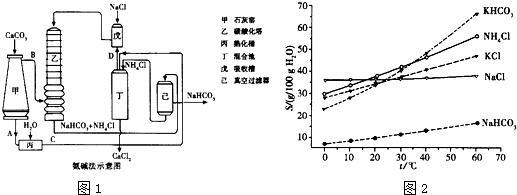
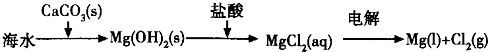
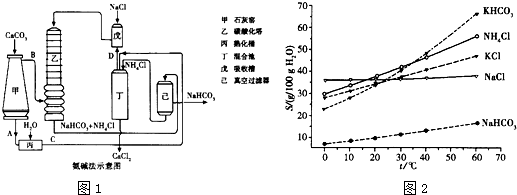
(14分)Ⅰ.下列实验操作或对实验事实的描述正确的是 (填序号)
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉;
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低;
③ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
④ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑤ 向NaOH溶液、KSCN溶液、沸腾的蒸馏水中分别滴加饱和的FeCl3溶液得到的分散系依次为:浊液、溶液、胶体
Ⅱ.某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:
(1)装置中试管B的作用是 。
(2)实验中可观察到石英管A中的现象为 。
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。写出该反应的化学方程式 。
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:
(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(ii)下列有关步骤④的操作中说法正确的是 。
a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为 。
(14分)Ⅰ.下列实验操作或对实验事实的描述正确的是 (填序号)
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉;
②配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低;
③试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后 管壁上有“银镜”出现
管壁上有“银镜”出现
④分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑤向NaOH溶液、KSCN溶液、沸腾的蒸馏水中分别滴加饱和的FeCl3溶液得到的分散系依次为:浊液、溶液、胶体
Ⅱ.某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:
(1)装置中试管B的作用是 。
( 2)实验中可观察到石英管A中的现象为 。
2)实验中可观察到石英管A中的现象为 。
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。写出该反应的化学方程式 。
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:
(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(ii)下列有关步骤④的操作中说法正确的是 。
a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com