
题目列表(包括答案和解析)
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)

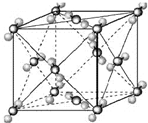 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.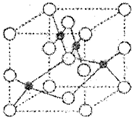
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为???????? ,X、Y、Z中第一电离能最大的是???????? 。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
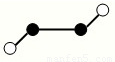
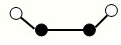
该分子中Y原子的杂化方式是???????? 。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是???? (填正确答案编号)。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为????????????? 。
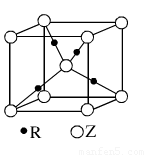
(5)R的基态原子的电子排布式为????????? ,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为????????? ,该晶体的密度为a g·cm-3,则晶胞的体积是????????? cm3。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com