
题目列表(包括答案和解析)
| 100 |
| x |
| 44 |
| 4.4g |
| 100 |
| x |
| 44 |
| 4.4g |
| 实验步骤 | 简答 |
1、按图连接好装置; |
1、写出①和②的仪器名称 ① 试管 试管 ② 量筒 量筒 |
| 2、用天平准确称取氢氧化钠样品2g,放人仪器①中,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处 | 2、B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其理由是 避免二氧化碳溶解在水里而损耗,造成测定结果偏低 避免二氧化碳溶解在水里而损耗,造成测定结果偏低 |
| 3、向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴人仪器①中至过量,关闭活塞.反应结束后,②中收集到饱和二氧化碳水溶液220mL. | 3、①判断实验步骤3中滴入的稀硫酸已过量的标志是 稀硫酸滴在样品上没有气泡产生 稀硫酸滴在样品上没有气泡产生 ,写出产生气泡的化学反应方程式:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ |
| 4、经计算样品中碳酸钠的质量分数为53.0%. | 4、集气瓶中收集到二氧化碳的质量是 0.44 0.44 g.(在27℃,101kPa时二氧化碳的密度约为2g/L;二氧化碳的体积等于排出的饱和二氧化碳水溶液的体积). |
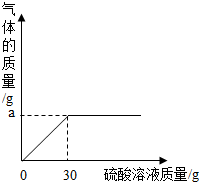 (2013?柳州)草木灰是农家肥料,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等,化学兴趣小组为测定某草木灰样品中的有效成分,取100草木灰于烧杯中,不断滴入稀硫酸溶液,当滴入30g稀硫酸时,不再有气泡产生,此时烧杯中的残余混合物的质量为127.8g.
(2013?柳州)草木灰是农家肥料,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等,化学兴趣小组为测定某草木灰样品中的有效成分,取100草木灰于烧杯中,不断滴入稀硫酸溶液,当滴入30g稀硫酸时,不再有气泡产生,此时烧杯中的残余混合物的质量为127.8g.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com