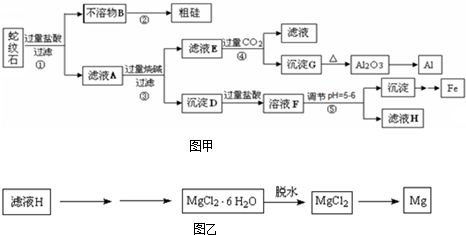
(2012?闸北区二模)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl
2?2H
2O晶体的工艺流程如下:
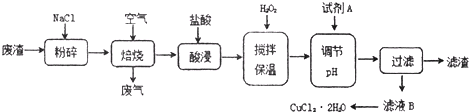
己知:①焙烧过程中发生的主要反应为:CuS+2NaCl+2O
2→CuCl
2+Na
2SO
4请参照表中给出的数据回答:
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe3+ |
1.9 |
3.2 |
| Fe2+ |
7.0 |
9.0 |
| Cu2+ |
4.7 |
6.7 |
(1)焙烧时还有废气产生,其中一种是主要的大气污染物.若在实验室中以碱液吸收处理之,下列(图1)A、B、C装置中可行的是
AB
AB
(填字母).
(2)H
2O
2的作用是:
氧化Fe2+
氧化Fe2+
.
(3)调节溶液pH的范围是
3.2至4.7
3.2至4.7
,试剂A可以选择
cd
cd
(填写选项字母).
a.KOH b.氨水
c.Cu
2(OH)
2CO
3 d.CuO
(4)为了获得CuCl
2?2H
2O晶体,对滤液B进行的操作是:
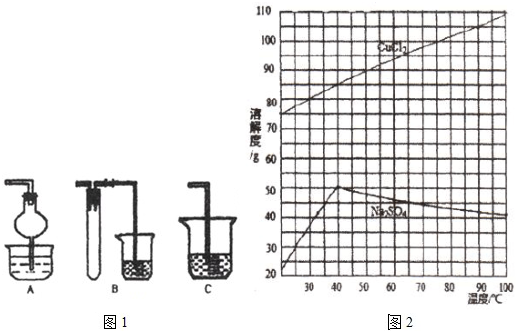
蒸发浓缩
蒸发浓缩
,趁热过滤,滤液经冷却结晶,过滤得到产品.分析有关物质的溶解度曲线(如图2),“趁热过滤”得到的固体是
Na2SO4
Na2SO4
(填化学式).
(5)滤液B中除OH
-外阴离子还有
S042- Cl-
S042- Cl-
.
(6)请描述检验滤液B中上述阴离子(除OH
-外)的实验操作
取少量滤液,先加过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-
取少量滤液,先加过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-
.