
题目列表(包括答案和解析)

第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
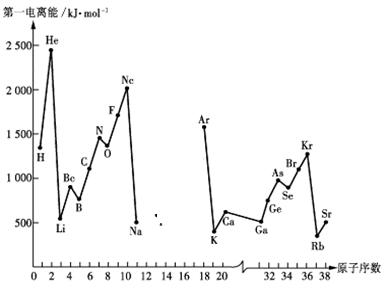
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na——Ar元素中,Al的第一电离能的大小(最小)范围为 <Al< (填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中第一电离能最小的元素在周期表中的位置是________________________;
(4)根据对角线规则,Be、Al元素最高氧化物水化物的性质相似,它们都具有 性,其中Be(OH)2显示这种性质的离子方程式是:________________________ ___、______________________________________。
(5)单质C不可能具有的性质是
A.具有良好的导电性
B.熔沸点很高
C.硬度较小
D.易与Br单质反应,形成的化合物分子是极性分子。
|
第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失).
下列说法错误的是: | |
A. |
Al的第一电离能的大小范围为Na<Al<Mg |
B. |
从上图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次增大 |
C. |
上图中第一电离能最小的元素在周期表中的位置是第五周期,IA族 |
D. |
根据对角线规则,Be、Al元素最高氧化物水化物的性质相似,它们都具有两性. |
(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。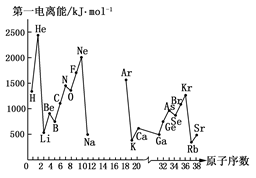
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
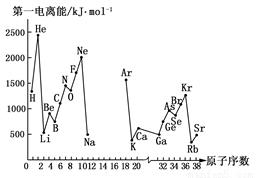
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com