A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图1所示(部分反应条件及产物略去).
(1)若A是一种黄色单质固体,则B→C的化学方程式为
.
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为
过氧化钠
过氧化钠
,试用化学方程式表示该物质与二氧化碳气体的反应
2Na2O2+2CO2=2Na2CO3+O2↑
2Na2O2+2CO2=2Na2CO3+O2↑
.将C长期露置于空气中,最后将变成物质D,D的化学式为
Na2CO3
Na2CO3
.
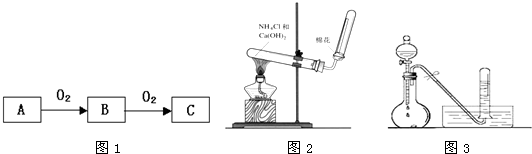
(3)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体.如图2所示是实验室制取A气体的装置,请结合所学知识,回答下列问题:
①收集A的方法是
向下排空气法
向下排空气法
,验证A是否已经收集满的方法是
向下排空气法;将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满;
(或用白色的酚酞试纸置于试管口处,若试纸变红,则证明氨气已收集满)
(或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满)
向下排空气法;将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满;
(或用白色的酚酞试纸置于试管口处,若试纸变红,则证明氨气已收集满)
(或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满)
(任写一种).
②写出实验室制取A的化学方程式
Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O
Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O
.
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为
2.24
2.24
L.
④试写出C与水反应的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
,反应可得到酸X,X是
强
强
电解质(填“强”或“弱”).如图3所示:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
.实验完毕后,试管中收集到的气体的主要成分为
NO
NO
(写化学式)

