
题目列表(包括答案和解析)
科学家用NaNO3和Na2O在一定条件下化合制得晶体A,A由钠离子和某阴离子B构成,则:
(1)A的化学式为________,A与Na3PO4比较,化学活泼性比Na3PO4________(填强或弱);
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为:________;
(3)此外,科学家还制备了另一种钠盐D,其与A的组成元素完全相同,D中的阴离子与A中的阴离子表观形式相同(元素种类和原子个数均相同),但D中阴离子的结构中含有一个过氧键:-O-O-,电导实验表明,同条件下其电导能力与NaCl相同,该阴离子的化学式为________,其与水反应生成过氧化氢的离子方程式为________,该反应________(填是或不是)氧化-还原反应
(15分).I下表是部分短周期元素的原子半径及主要化合价:
| 元素代号[ | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
试用元素符号、化学式回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有 ;
X可与W组成含18电子的化合物乙,则乙的电子式为 。
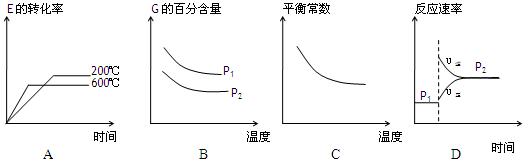
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g)2G(g)根据下表中的数据判断下列图像错误的是 。
|
| p1(MPa) | P2(MPa) |
| 200 | 78.4 | 90.6 |
| 600 | 72.3 | 88.6 |
![]()
II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。
(1)若M为氢氧化钾溶液,
(2)若M为熔融的碳酸钾
(3)若M为传递O2-的固体电解质
III一定量的浓硝酸与足量的铁铜合金反应,硝酸被还原
为NO 、 NO2 、 N2O4,其标准状况下的体积均为112mL ,若向所得溶液中加入0.1mol/L的氢氧化钠溶液 mL恰好能使溶液中的金属离子沉淀完全。
(10分)科学家用NaNO3和Na2O在一定条件下化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为 ,
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为: ;
(3)此外,科学家还制备了另一种钠盐D,其与A的组成元素完全相同,D中的阴离子与A中的阴离子表观形式相同(元素种类和原子个数均相同),但D中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,该阴离子的化学式为 ,其与水反应生成过氧化氢的离子方程式为 ,该反应 (填是或不是)氧化-还原反应
(15分).I下表是部分短周期元素的原子半径及主要化合价:
| 元素代号[ | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
 、化学式回答下列问题:
、化学式回答下列问题: 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。 | p1(MPa) | P2(MPa) |
| 200 | 78.4 | 90.6 |
| 600 | 72.3 | 88.6 |
|
 II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。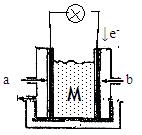
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com