
题目列表(包括答案和解析)
| A、1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数) | B、原电池的负极发生氧化反应,电解池的阳极发生还原反应 | C、Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+ | D、Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存 |

| ||
| ||
锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
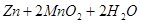 =
=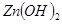
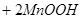 ,下列说法错误的是
,下列说法错误的是
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为: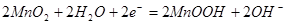
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过 电子,锌的质量理论上减少
电子,锌的质量理论上减少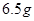
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com