
题目列表(包括答案和解析)
铅蓄电池的示意图如右图所示。下列说法正确的是
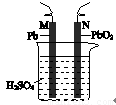
A.放电时,N为负极,其电极反应式为: PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变,两极的质量增加
C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
铅蓄电池放电时发生下列变化:负极:Pb+SO42—-2e-===PbSO4 正极:PbO2+4H++SO42—+2e-===PbSO4+2H2O,使用该电池电解CuSO4溶液,要得到纯铜1.6 g,这时铅蓄电池消耗的H2SO4的物质的量为
A.0.025 mol B.0.05 mol C.0.1 mol D.0.2 mol
 2PbSO4+2H2O,据此判断下列叙述正确的是
2PbSO4+2H2O,据此判断下列叙述正确的是 铅蓄电池的示意图如图所示。下列说法正确的是
A.放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变,两极的质量增加
C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com