
题目列表(包括答案和解析)
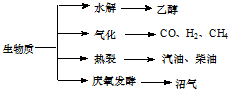 生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |

(14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
(14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
(14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com