
题目列表(包括答案和解析)
概念:在溶液中盐电离出来的离子跟水电离出来的
________或________结合生成________电解质的反应,叫盐类的水解.下列说法中犯了哪些概念性错误:
A.1mol H2SO4与1mol Ba(OH)2完全中和所放出的热量为中和热
B.强酸和强碱的稀溶液发生中和反应一定是放热反应,但弱酸和弱碱反应不一定是放热反应,所以盐类水解不一定全是吸热反应
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应
D.在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热
| |||||||||||||||
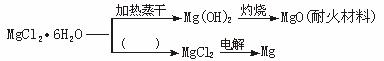
请回答下列问题:
(1)在图中的括号内填写适当的反应条件。
(2)Mg(OH)2固体存在如下溶解平衡:
Mg(OH)2(s)![]() Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
(3)NaF和MgO的核间距离分别为2.31×10-10 m和2.10×10-10 m,但两者的熔点分别为993 ℃和2852 ℃。试解释其可能的原因。
(4)依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料,可以获得28.8 kg MgO、________kg 36.5%的盐酸和________kg MgCl2。
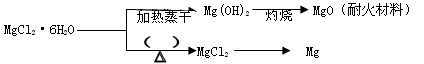
 Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________有利于Mg(OH)2溶解。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com