
题目列表(包括答案和解析)
(1)Al13代表的含义是____________。
A.铝是13号元素 B.铝原子有13个电子
C.铝原子有13个质子 D.由13个铝原子组成的新物质
(2)科学家预言“超级原子”的发现将会重建周期表,因为Al13、Al14的性质很像现行元素周期表中的某主族元素。已知当这类“超级原子”具有40个价电子时最稳定(铝原子具有3个价电子),类似于稀有气体的最外层8个电子的稳定性。
①铝在元素周期表中的位置:第______________周期第______________族,其原子结构示意图为______________。
②Al13有39个价电子,所以与______________(填主族)的元素性质类似;Al14有______________个价电子,且与______________的元素性质相似。
(3)这些“超级原子”的制备方法是:首先在实验室中将金属铝制成蒸气,在这个过程中会形成一些由多个铝原子组成的极其微小的球体,用质谱仪从铝蒸气中可以过滤出Al13“超级原子”,也就是说由13个铝原子组成的小球最稳定,这些“超级原子”能够与呈链形的碘分子发生化学反应,反应原理是Al13“超级原子”取代了碘分子中的一个碘原子的位置,其他碘原子也“悬挂”在Al13“超级原子”上。
①关于“超级原子”Al13与碘反应的产物叙述错误的是______________。
A.是一种新的碘铝化合物
B.是碘与铝的混合物
C.该物质具有碘的性质
D.该物质具有铝的性质
②“超级原子”Al13在气相中还能与HI发生化合反应,请你写出这个反应的化学方程式_____________________________________________________________________。
(10分)在本世纪20年代末,L.Pauling在大量含氧酸盐结构资料的基础上系统总结了关于离子化合物的五个规则。这些结构规则对诸如硅酸盐结构化学规律的总结和研究起了重大的推动作用。电价规则是鲍林五个规则的核心。它可表述为:在一个稳定的离子化合物结构中,每一负离子的电价等于或近似等于从邻近的正离子至该负离子的各静电键强度的总和,即ζ=![]() =
=![]() 式中:ζ为负离子的电荷;Si是i种正离子至每一配位负离子的静电键强度;Si定义为ωi/νi;ωi是正离子的电荷数;νi为其配位数。这一规则的物理基础在于:如在结构中正电位较高的位置安放电价较高的负离子时,结构会趋于稳定,而某一正离子至该负离子的静电键的强度ω/ν正是有关正离子在该处所引起正电位的量度。
式中:ζ为负离子的电荷;Si是i种正离子至每一配位负离子的静电键强度;Si定义为ωi/νi;ωi是正离子的电荷数;νi为其配位数。这一规则的物理基础在于:如在结构中正电位较高的位置安放电价较高的负离子时,结构会趋于稳定,而某一正离子至该负离子的静电键的强度ω/ν正是有关正离子在该处所引起正电位的量度。
1.化学式为Be3Al2[Si6O18]的绿柱石是含铍的矿物。结构中所有的Si4+均处于氧离子所组成的四面体空隙之中,键强Ssi-O= ,根据电价规则, 个Si-O键的键强和恰等于氧离子的电价数,决定了O2-可为 个硅氧四面体所公用。已知绿柱石中硅氧骨干外的Be2+分别处于O2-(硅氧骨干中的非公用氧离子)所组成的四面体的空隙中。硅氧骨干中每一个非公用的O2-各与一个Si4+、Be2+、Al3+相连,根据电价规则诸静电键强之和恰等于O2-之电价。则Al3+处于O2-(硅氧骨干中的非公用氧离子)所组成的_______体的空隙中。
2.以4价钒化合物VOSO4与盐酸羟胺为原料,在水溶液中以KOH调节pH≈4的条件下制得一种七配位的钒化合物[VO?(NH2O)2?(NH3O)?H2O]Cl。由晶体结构分析所得的键长算得诸键的键价如下:
键 | V-O(1) | V-O(2) | V-N(2) | V-O(3) | V-N(3) | V-O(4) | V-OH2 |
S | 1.811 | 0.639 | 0.581 | 0.707 | 0.596 | 0.526 | 0.220 |
产物中的钒为 价
 3.腺苷三磷酸(ATP)因其分子含有“高能键”(实为亚稳键)而在生物化学代谢过程中起着特别重要的作用。它可以通过水解反应使“高能”(即亚稳)磷酸键解离而起到能量传递的作用。已知正磷酸根PO43-中的P-O链长0.15nm,而ATP中的上述P-O键,已延伸至0.16nm,有力地佐证了此P-O亚稳键的起因。能否通过电价规则计算来证明。
3.腺苷三磷酸(ATP)因其分子含有“高能键”(实为亚稳键)而在生物化学代谢过程中起着特别重要的作用。它可以通过水解反应使“高能”(即亚稳)磷酸键解离而起到能量传递的作用。已知正磷酸根PO43-中的P-O链长0.15nm,而ATP中的上述P-O键,已延伸至0.16nm,有力地佐证了此P-O亚稳键的起因。能否通过电价规则计算来证明。
A.《物质结构与性质》模块(12分)
二茂铁【(C5H5)2 Fe】是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:
2C5H6+Fe(还原铁粉)![]() (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: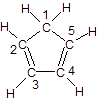 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),![]() 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
B.《实验化学》模块(12分)
(12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是: 。
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入 (填化学式)试剂可达这一目的。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”)。
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN
(填“>”或“<”)。
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com