
题目列表(包括答案和解析)
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。

(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:????????????????????????
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立;
若____________________,假设二成立;
若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。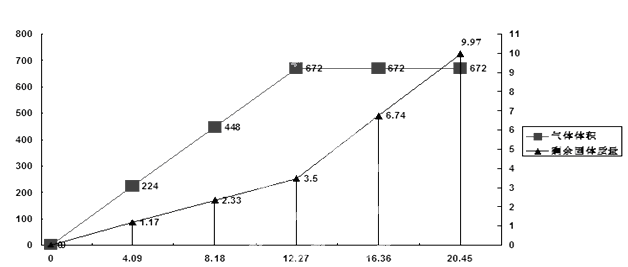
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
| 实验操作 | 预期实验现象和结论 |
| | 若____________________,假设一成立; 若____________________,假设二成立; 若____________________,假设三成立。 |
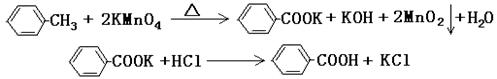
甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理: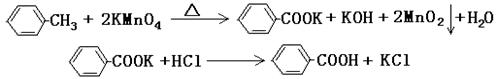
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。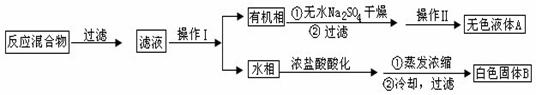
已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, , | 得到白色晶体和无色溶液 |  |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体, | 熔点为122.4℃ | 白色晶体是苯甲酸 |
下列有关物质性质应用的说法正确的是
A.SO2具有漂白性,可用作熏蒸粉丝使其增白
B.常温下二氧化硅不与强酸反应,可用石英容器盛放氢氟酸
C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:

已知:几种化合物的溶解度(S)随温度(T)变化曲线如下图所示。
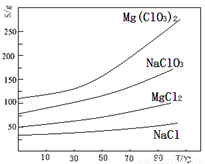
(1)过滤时主要玻璃仪器有 。加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是: 。
(3)“调节pH=4”可选用的试剂是 (填编号)
①MgO ②CuO ③稀NaOH溶液
④Mg ⑤稀硫酸 ⑥MgCO3
(4)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+。记录消耗K2Cr2O7溶液的体积。
①步骤2中发生反应的离子方程式为: 。
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则产品中Mg(ClO3)2·6H2O的含量会 。(填“偏高”、“偏低” 或“不变”)。
甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

已知:苯甲酸分子量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
|
序号 |
实验方案 |
实验现象 |
结论 |
|
① |
将白色固体B加入水中, , |
得到白色晶体和无色溶液 |
|
|
② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含有Cl- |
|
③ |
干燥白色晶体, |
熔点为122.4℃ |
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol。产品中甲苯酸质量分数的计算表达式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com