
题目列表(包括答案和解析)
(12分,每空2分)
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
899 |
1 757 |
14 840 |
21 000 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
①请根据上述信息,写出A基态原子的核外电子排布式:__________________。
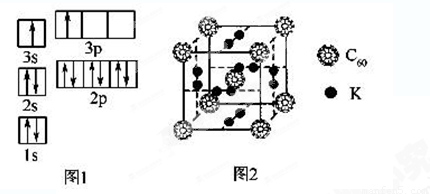
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |


已知:A既是甘蔗渣也是淀粉水解的最终产物,C分子中含有一个甲基,A、C具有相同的最简式,且M(A)=2M(C)。
回答下列问题:
(1)写出下列物质的结构简式:B____________、F____________;
(2)写出下列反应的化学反应方程式并指出反应类型
C→D:____________,反应类型____________;
G![]() H的钠盐:____________,反应类型____________;
H的钠盐:____________,反应类型____________;
(3)任意写出C的两种同分异构体的结构简式:____________、____________;
(4)经测定
1.《有机化学基础》芬必得是一种高效的消炎药,其主要成分为布洛芬,它有多种合成路线,如图就是一种合成方法。
已知卤代烃有如下反应:R—Cl+NaCN![]() R—C≡N+NaCl。
R—C≡N+NaCl。

回答下列问题:
(1)写出D的结构简式:____________________。
(2)写出反应类型:A→B____________,B→C____________。
(3)C和苯酚的关系是____________。
a.互为同分异构体 b.互为同系物
c.均为芳香族化合物 d.均属于芳香烃
(4)写出C发生消去反应的化学方程式(注明反应条件):__________________________。
(5)与A具有相同分子式,且苯环上只有一个取代基的有机物共有四种,除A的结构外,写出其余三种结构简式中的任意两种:
_____________________________、____________________________。
2.《物质结构与性质》纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |

(1)某同学根据上述信息,推断B的核外电子排布如上图所示,该同学所画的电子排布图违背了____________。
(2)根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为____________。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
(4)已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145—140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由_________________________。
(5)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为____________。

(6)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是__________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
乙醇是重要的化工原料和液体燃料,可以利用下列反
应制取乙醇:
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是________________________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
|
|
500 |
600 |
700 |
800 |
||
|
1.5 |
45 |
33 |
20 |
12 |
||
|
2.0 |
60 |
43 |
28 |
15 |
||
|
3.0 |
83 |
62 |
37 |
22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________;平衡常数K______________。(填“增大”、“减小”、或“不变”)
 (4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
影响,并对图中横坐标、纵坐标的含义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇
与氧作用生成水和二氧化碳。该电池的负极反应式为:
___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式_______________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com