
题目列表(包括答案和解析)
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2 (g) 2CO(g) △H= + 172.5 kJ·mol-1
2CO(g) △H= + 172.5 kJ·mol-1
则反应:Fe2O3
(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值
.(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值
.(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
|
|
Fe2 O3 |
CO |
Fe |
CO2 |
|
甲容器 |
1.0 mol |
1.0 mol |
1.0 mol |
1.0 mol |
|
乙容器 |
1.0 mol |
2.0 mol |
1.0 mol |
1.0 mol |
①甲容器中CO的平衡转化率为
②下列说法正确的是 (填字母)。
a.乙容器中CO的平衡转化率小于甲容器
b.甲、乙容器中,CO2的平衡浓度之比为2:3
c.当容器内气体压强保持不变时,标志反应达到平衡状态
d.当容器中气体密度保持不变时,标志反应达到平衡状态
(4)钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
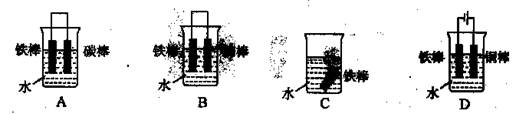
①下列哪个装置可防止铁棒被腐蚀 (填编号)。

②在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2(g) 2CO(g) △H=" +" 172.5 kJ·mol-1
2CO(g) △H=" +" 172.5 kJ·mol-1
则反应:Fe2O3(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| | Fe2 O3 | CO | Fe | CO2 |
| 甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
| 乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com