
题目列表(包括答案和解析)
 Br2+SO2↑+2H2O,②Br2+SO2+2H2O=2HBr+H2SO4。下列有关说法中正确的是()。
Br2+SO2↑+2H2O,②Br2+SO2+2H2O=2HBr+H2SO4。下列有关说法中正确的是()。①H2+CuSO4===CuS↓+H2SO4②2NaCl(s)+H2SO4(浓)====Na2SO4+2HCl↑③Br2+SO2+2H2O===2HBr+H2SO4针对上述三个反应.下列说法中正确的是( )
A. 从反应①可知酸性:H2S强于H2SO4,
B. 从反应②可知酸性:H2SO4强于HCI
C. 从反应③可知氧化性:Br2>浓硫酸
D. 以上说法都不对
 写出木炭与浓硫酸反应的化学方程式
写出木炭与浓硫酸反应的化学方程式
| ||
| ||
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。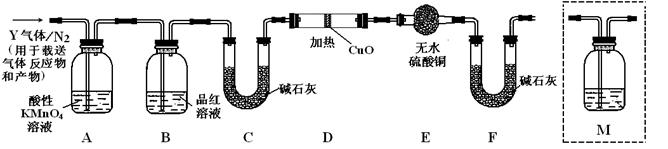
(3)装置B中试剂的作用是
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,,需在装置中添加洗气瓶M于 (填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr +H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
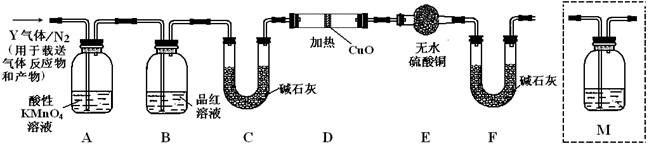
(3)装置B中试剂的作用是
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,,需在装置中添加洗气瓶M于 (填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com