
题目列表(包括答案和解析)
工业合成氨气的成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
(1) 下图装置中能用于实验室制NH3的是____________.

(2) 写出用NH4Cl和Ca(OH)2制取氨气的反应方程式:_______________.
(3) 将湿润的红色石蕊试纸伸入充满氨气的试剂瓶中可以看到的现象是___________________.
(4) NH3在工业上除作为制作化肥的原料外,也常用来制取硝酸,其主要步骤为:![]()
请写出下列反应的化学方程式:
NH3 ![]() NO : _________________________________________.
NO : _________________________________________.
Cu和浓硝酸反应:___________________________________________.
氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是 (填序号)。
A.向生石灰中滴入浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20 M Pa~50 M Pa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。


图Ⅰ 图Ⅱ
① 用滴定管盛氨水前,滴定管要用 润洗2~3遍,
② 试计算该种氨水的浓度: 。
③ 下列情况下,会导致实验结果c(NH3·H2O)偏低的是 。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
(4) 1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。

正极的电极反应式为: 。
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应为:N2(g)+3H2(g)![]() 2NH3(g);ΔH<0.
2NH3(g);ΔH<0.
①下列措施可以提高H2的转化率的是(填选项序号)________.
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
②一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g);ΔH>0.
2NO2(g);ΔH>0.
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2,t4时刻只改变一个条件,下列说法正确的是(填选项序号)________.

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);ΔH=+67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是________.
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式是________.
|
下列反应中,既属于离子反应,又属于有颜色变化的氧化还原反应的是 | |
| [ ] | |
A. |
氯化钡溶液、硝酸与硫酸钾溶液混合 |
B. |
电解含酚酞的饱和食盐水 |
C. |
硫酸铜溶液与氢氧化钠溶液混合 |
D. |
工业上合成氨气 |
实验室用N2、H2合成氨气,并用酚酞试液检验生成的NH3.用锌与盐酸反应制取H2;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取N2:
NaNO2+NH4Cl=NaCl+NH4NO2
NH4NO2![]() N2↑+2H2O
N2↑+2H2O
制备装置如下图所示:
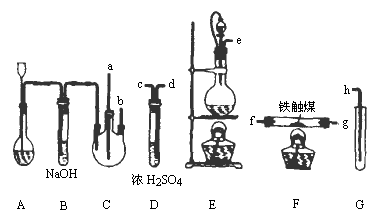
(1)装置A用于制取________.
(2)装置E中分液漏斗上方常用导管与圆底烧瓶内相通,作用是________.装置E与装置C直接相连,连接时导管口连接方法为e接________.
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:另一接口________接________,________接________,________接________.
(4)装置D的作用为________.装置F导出的气体成分为________.
(5)装置G内盛滴有酚酞的试液,用于检验NH3的生成.该装置中导管口能否插入液面以下________(填“能”或“不能”),理由是________.
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应怎样处理为佳?答:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com