
题目列表(包括答案和解析)
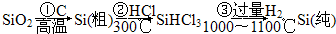
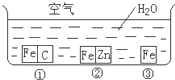 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: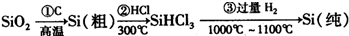
| ||
| ||


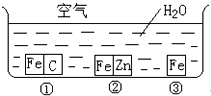 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:某实验小组利用饱和食盐水、导线、直流电源(用“” 或“
”表示)、烧杯、灵
敏电流计(用“”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象产生,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。
请根据上述同学的实验现象回答以下问题:
(1)M电极棒材料是(写化学式) ,N电极棒材料是(写化学式) 。
(2)在下列虚框内完成对应三个同学的装置图:
(3)按要求写出三个同学实验过程中涉及的反应方程式:
甲同学N电极方程式
乙同学总反应的离子方程式
丙同学N电极方程式
(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因:
。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式) 。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3[Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com