
题目列表(包括答案和解析)
在pH=0和pH=14的溶液中,都能大量共存的离子组是 ( )
A.Cu2+、Na+、Mg2+、NO3- B. K+、Cl-、I-、SO42-
C.S2O32-、Na+、K+、AlO2- D. NO3-、H2PO4-、NH4+、Ag+
(14分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
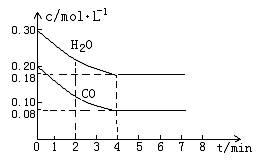
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol??L-1??min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。
图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
(3)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是_______
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃ 时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是 。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com