
题目列表(包括答案和解析)
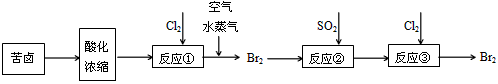
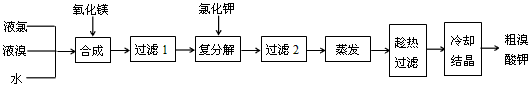
 KI3
KI3

| 实验(混合溶液) | A | B | C | D | E | F |
| 4mol/L 盐酸/mL | 60 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuCl2溶液/mL | 0 | 1.0 | 5.0 | 10 | V6 | 40 |
| H2O/mL | V7 | V8 | V9 | V10 | 20 | 0 |
某同学在用稀盐酸与铁制取氢气的实验中,发现加入少量氯化铜溶液可加快氢气的生成速率。请回答下列问题:
(1)要加快上述实验中气体产生的速率,还可采取的措施有
(答两种);
(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是 ;
(3)为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验(混合溶液) | A | B | C | D | E | F |
| 4mol/L 盐酸/mL | 60 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuCl2溶液/mL | 0 | 1.0 | 5.0 | 10 | V6 | 40 |
| H2O/mL | V7 | V8 | V9 | V10 | 20 | 0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuCl2溶液时,生成氢气的速率会
大大提高。但当加入的CuCl2溶液超过一定量时,生成氢气的速率反而会下降。
请分析氢气生成速率下降的主要原因
某同学在用稀盐酸与铁制取氢气的实验中,发现加入少量氯化铜溶液可加快氢气的生成速率。请回答下列问题:
(1)要加快上述实验中气体产生的速率,还可采取的措施有
(答两种);
(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是 ;
(3)为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验(混合溶液) | A | B | C | D | E | F |
| 4mol/L 盐酸/mL | 60 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuCl2溶液/mL | 0 | 1.0 | 5.0 | 10 | V6 | 40 |
| H2O/mL | V7 | V8 | V9 | V10 | 20 | 0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuCl2溶液时,生成氢气的速率会
大大提高。但当加入的CuCl2溶液超过一定量时,生成氢气的速率反而会下降。
请分析氢气生成速率下降的主要原因
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com