
题目列表(包括答案和解析)
| 3 |
| 4 |
| ||
| △ |
| ||
| △ |
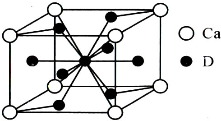 (5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=(11分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)D位于元素周期表第 周期 族。
 (2)C和E两元素相比较,非金属性较强的是__________(填元素名称),可以验证该结论的是_________________(填写编号);
(2)C和E两元素相比较,非金属性较强的是__________(填元素名称),可以验证该结论的是_________________(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
。
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的
离子方程式为 ;
(5)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
.
(11分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)D位于元素周期表第 周期 族。 (2)C和E两元素相比较,非金属性较强的是__________(填元素名称),可以验证该结论的是_________________(填写编号);
(2)C和E两元素相比较,非金属性较强的是__________(填元素名称),可以验证该结论的是_________________(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
。
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的
离子方程式为 ;
(5)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
.
A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题:
(1)写出B、C、E元素的名称B 、C 、E 。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为 。
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号)
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为 、 ,这两种酸式盐相互反应的离子方程式为 。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为 。
①a mol ②b mol ③a/3 mol
④ b/3 mol ⑤0 ⑥(4a-b)mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com