
题目列表(包括答案和解析)
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。
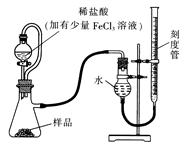
①实验前需进行的操作是 ,稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。
方案Ⅱ:用电子天平称取0.1000g样品置于锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,加入少量 作指示剂;然后用 式滴定管盛装0. 1000 mol/L Na2S2O3溶液进行滴定. (已知:I2+2Na2S2O3= Na2S4O6+2NaI)
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。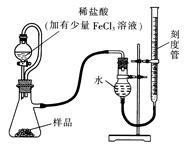
①实验前需进行的操作是 ,稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。
方案Ⅱ:用电子天平称取0.1000g样品置于锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,加入少量 作指示剂;然后用 式滴定管盛装0. 1000 mol/L Na2S2O3溶液进行滴定. (已知:I2+2Na2S2O3= Na2S4O6+2NaI)
(8分)
I已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
(1)氢气的燃烧热△H= kJ/mol
(2)燃烧2gH2生成水蒸气,放出的热量为 kJ。
Ⅱ把煤作为燃料可通过下列两种途径获得热量:
途径1:直接燃烧
C(s)+O2(g)=CO2(g) △H=E1 ①
途径2:先制成水煤气,再燃烧水煤气
C(s)+H2O(g)=CO(g)+H2(g) △H=E2 ②
H2(g)+1/2 O2(g)=H2O(g) △H=E3 ③
CO(g)+1/2 O2(g)=CO2(g) △H=E4 ④
请回答:
(1)上述四个热化学方程式中哪个反应△H >0? (填序号)
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
(填选项字母)。
A.途径1比途径2多 B.途径1比途径2少 C.途径1与途径2在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为 .
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
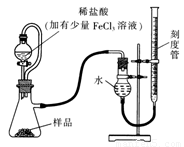
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 .稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。方案I中过氧化镁的质量分数为 (用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量 作指示剂;样品中过氧化镁的质量分数为 (用含V的表达式表示)。
本题16分,①下列两幅谱图是结构简式为CH3CH2CH2OH和CH3CH(OH)CH3的两种有机化合物的1H核磁共振谱图。请判断哪一幅是CH3CH(OH)CH3的1H—NMR谱图,并说明理由。(6分)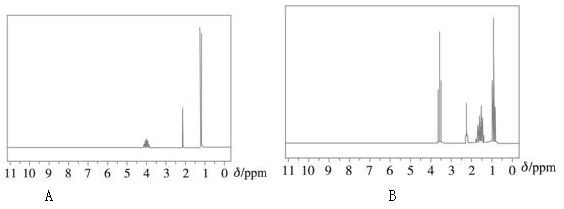
②、0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。燃烧后的这些产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO充分反应后,固体质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6 g。(可能用到的相对原子质量H-1,C-12,O-16,Cu-64)
(1)推断该有机物的分子式。(6分)
(2)若0.2 mol该有机物在与过量的金属钠完全反应后放出4.48 L H2(标准状况),试确定有机物的结构简式。(4分)?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com