
题目列表(包括答案和解析)
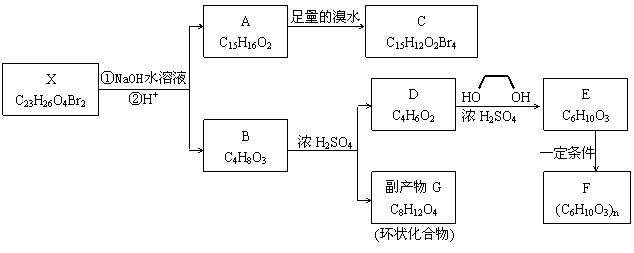
化合物X是一种环境激素,存在如下转化关系: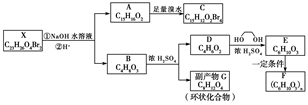
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1HNMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题:
(1)下列叙述正确的是________。
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)________________________________________________。
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__________________________________________________。
(5)写出E→F反应的化学方程式___________________________________________。
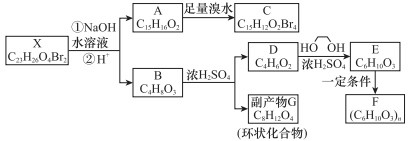
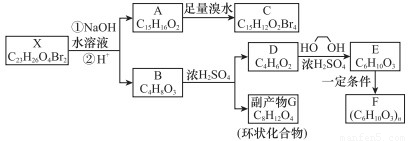
化合物X是一种环境激素,存在如下转化关系:
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H-NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题。
(1)下列叙述正确的是_________。
A.化合物A分子中含有联苯结构单元
B.化合物A可以和NaHCO3溶液反应,放出CO2气体
C.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH
D.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是_________________,A→C的反应类型是__________________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)________。
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式_______________________________________________。
(5)写出E→F反应的化学方程式_______________________________________________。
| 元素代号 | A | B | C | D | E | G | L | I |
| 原子半径/nm | 0.111 | 0.064 | 0.117 | 0.16 | 0.066 | 0.070 | 0.104 | 0.077 |
| 主要化合价 | +2 | -1 | +4,-4 | +2 | -2 | +5.-3 | +6,-2 | +4,-4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com