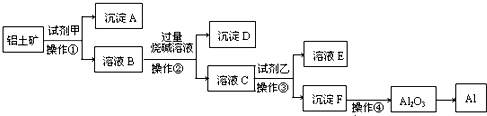
工业上冶炼钛主要以钛铁矿、金红石(含TiO
2大于96%)等为原料生产.

(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
①沸腾氯化炉中反应的化学方程式为:
TiO2+2Cl2+2C=TiCl4+2CO
TiO2+2Cl2+2C=TiCl4+2CO
②已知:Ti(s)+2Cl
2(g)=TiCl
4(l)△H=-804.2kJ/mol;
2Na(s)+Cl
2(g)=2NaCl(s)△H=-882.0kJ/mol
Na(s)=Na(l)△H=2.6kJ/mol
请写出用液态钠与四氯化钛置换出钛的热化学方程式
4Na(l)+TiCl4(l)=4NaCl(s)+Ti(s)△H=-970.2kJ/mol
4Na(l)+TiCl4(l)=4NaCl(s)+Ti(s)△H=-970.2kJ/mol
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的是
除去起中和过量的钠并溶解氯化钠及钛的氯化物
除去起中和过量的钠并溶解氯化钠及钛的氯化物
.
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺.试回答下列有关问题.
①TiO
2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,在阴极,被还原的Ca进一步还原TiO
2获得钛,则在阴极所发生的反应为:
2Ca2++4e-+TiO2=2CaO+Ti
2Ca2++4e-+TiO2=2CaO+Ti
.

②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO
2污染物产生,通入的气体若是H
2,则阳极电解反应式为
H2+O2--2e-=H2O
H2+O2--2e-=H2O
.