
题目列表(包括答案和解析)
(A)【物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
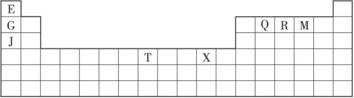
(1)T3+的核外电子排布式是____________。
(2)Q、R、M的第一电离能由大到小的顺序是___________________(用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是______________________(填序号)。
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线形分子,不存在配位键。写出其结构式:_________________。
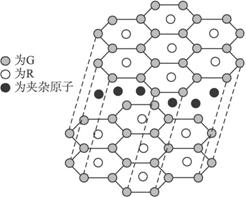
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是____________(填G或R的元素符号)。
(B)【实验化学】
某资料显示,能使双氧水分解的催化剂有很多种,生物催化剂(如猪肝)、离子型催化剂(如FeCl3)和固体催化剂(如MnO2)等都是较好的催化剂。某实验小组通过测定双氧水分解产生的O2的压强,探究分解过氧化氢的最佳催化剂以及探究最佳催化剂合适的催化条件。
(一)探究一:
实验步骤
(1)往锥形瓶中加入50 mL 1.5%的双氧水
(2)分别往锥形瓶中加
(3)采集和记录数据。
(4)整理数据得出下表
不同催化剂“压强对时间斜率”的比较
催化剂 | 猪肝 | 马铃薯 | 氯化铜 | 氯化铁 | 氧化铜 | 二氧化锰 |
压强对时间的斜率 | 0.191 87 | 0.002 42 | 0.007 93 | 0.030 5 | 0.015 47 | 1.833 6 |
①该“探究一”实验的名称是_____________________________________________________。
②该实验所得出的结论是_______________________________________________________。
(二)探究二:二氧化锰催化的最佳催化条件
该实验小组的同学在进行探究二的实验时,得到了一系列的图表和数据。参看下图和表格分别回答相关问题。
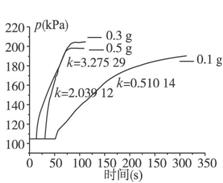
3%的双氧水与不同用量二氧化锰的压力—时间图
表:不同浓度的双氧水在不同用量的二氧化锰作用下收集相同状况下同体积O2所需时间
MnO2 时间 H2O2 | |||
1.5% | 223 s | 67 s | 56 s |
3.0% | 308 s | 109 s | 98 s |
4.5% | 395 s | 149 s | 116 s |
分析图、表中数据我们可以得出:
③同浓度的双氧水的分解速率随着二氧化锰用量的增加而_________________,因而反应时间_______________。
④如果从实验结果和节省药品的角度综合分析,你认为当我们选用3.0%的双氧水,加入___________ g的二氧化锰能使实验效果最佳。你判断的理由是______________________。
⑤该小组的某同学通过分析数据得出了当催化剂用量相同时双氧水的浓度越小反应速率越快的结论,你认为是否正确____________,你的理由是________________________________。
(12分)2010年诺贝尔物理学奖被两位英国科学家盖姆和诺沃肖格夫摘得,他们用普通胶带成功地从铅笔芯地石墨中分离出了石墨烯(分子式设为Cx),突破性地创造了撕 裂法:他们将石墨分离成小的碎片,从碎片中剥离出较薄的石墨薄片,然后用胶带粘住薄片的两侧,撕开胶带,薄片也随之一分为二,不断重复这一过程,最终得到了截面约100微米的、只有单层碳原子的石墨烯。这种“只有一层碳原子厚的碳薄片”,被公认 为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料。这种比最好的钢铁 还要硬100倍、比钻石坚硬的石墨烯其实就是石墨的二维结构。其超强硬度、韧性和出 色的导电性使得制造超级防弹衣、超轻型火箭、超级计算机不再是科学狂想。
⑴下列说法不正确的是 ▲ 。
A.石墨烯被公认为目前世界上已知的最薄、最坚硬的新型材料,所以他属于原子晶体
B. 石墨烯与金刚石互为同素异性体
C. 若该撕裂法可看做是将石墨结构内层与层间分离开,则此过程中必有共价键被破坏
D. 石墨烯晶体内最小环上有6个原子
E. 石墨烯可看做是芳香烃类的物质
F. 石墨烯晶体在一定条件下可发生加成反应
⑵石墨烯可能具有较强的 ▲ (填“氧化性”或“还原性”),因此在足量空气中煅烧可能发生的反应方程式为 ▲ 。
⑶石墨烯之所以能导电,可认为主要是因为其每个碳原子成键后还有一个单电子,这些单电子均可与最近的3个碳原子中任意一个碳原子形成共价键,也就是说具有该结构的物质一般具有导电性,据此类推下列物质不具有导电性的是 ▲ 。
A. 石墨 B. 聚乙炔 C. 聚1,3-丁二烯 D. 聚苯乙炔
⑷ 18g石墨烯晶体内含有的碳原子数为 ▲ ,所含的碳碳单键数为 ▲ 。
(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
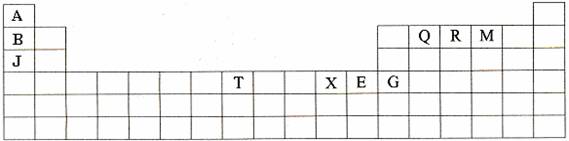
(1)T3+的核外电子排布式是: 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是: (填序号)。
①B单质的熔点高于J单质,是因为B单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RA3沸点高于QA4,主要是因为前者相对分子质量较大
⑤一个Q2A4分子中含有五个σ键和一个![]() 键
键
(4)加拿大天文台在太空发现了AQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式: 。
(5)B与R单质直接化合生成一种离子化合物B3R。该晶体具有类似石墨的层状结构。每层中,B原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填B或R的元素符号)。
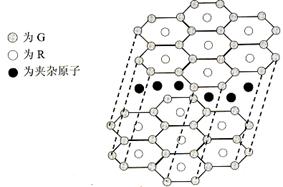
(6)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。但G的第一电离能却明显低于E,原因是 。
 CO↑+H2O 请根据以下各图进行选择形成一套相对较为合理的实验装置图(某些装置可重复使用)
CO↑+H2O 请根据以下各图进行选择形成一套相对较为合理的实验装置图(某些装置可重复使用) 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com