(2013?重庆模拟)I.将由Na
+、Ba
2+、Cu
2+、SO
42-、Cl
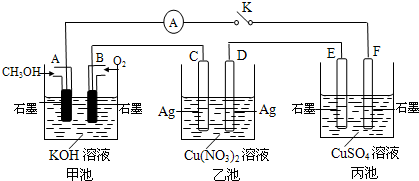
-组合形成的三种强电解质溶液,分别装入图1装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.

接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图2(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式
;
(2)电极f上发生的电极反应为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是
向丙烧杯中加入水2.25g
向丙烧杯中加入水2.25g
.
II.工业上利用BaSO
4制备BaCl
2的工艺流程如下:

某活动小组的同学在实验室以重晶石(主要成分BaSO
4)为原料,对上述工艺流程进行模拟实验.
(1)上述过程中,气体用过量NaOH溶液吸收得到Na
2S.Na
2S水溶液显碱性的原因是
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
(用离子方程式表示).
(2)已知有关反应的热化学方程式如下:
BaSO
4(s)+4C(s)
4CO(g)+BaS(s)△H
1=+571.2kJ/mol
C(s)+CO
2(g)
2CO(g)△H
2=+172.5kJ/mol
则反应BaSO
4(s)+2C(s)
2CO
2(g)+BaS(s)△H
3=
+226.2
+226.2
kJ/mol
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是
使BaSO4得到充分的还原(或提高BaS的产量)
使BaSO4得到充分的还原(或提高BaS的产量)
,
硫酸钡和碳反应为吸热反应,炭和氧气反应放热维持反应所需高温
硫酸钡和碳反应为吸热反应,炭和氧气反应放热维持反应所需高温
.


 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL.
