
题目列表(包括答案和解析)
A、B、C是原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2。请回答:
(1)D元素较稳定的化合价是 。
(2)C与A形成的最简单分子是 分子(填:“极性”或“非极性”),该分子再与A+元素结合成离子时,ACA键的键角发生改变,其原因是
(3)在烃中,若要求所有的原子都有可能在同一个平面中,则对碳原子成键轨道的要求是:
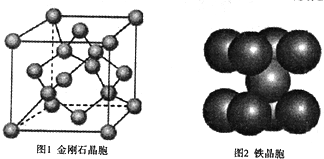
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原子。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是
 (5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。
已知A、B、C是原子序数依次增大的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子排布式为![]() ,C元素的第一电离能在同族元素中最大且高于与其同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子排布式为
,C元素的第一电离能在同族元素中最大且高于与其同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子排布式为![]() 。
。
请回答:
(1)D元素较稳定的化合价是__。
(2)C与A形成的最简单分子是__分子(填:“极性”或“非极性”),该分子再与A+结合形成离子时,ACA键的键角发生改变,其原因是 ___
(3)在烃中,若要求所有的原子都有可能在同一个平面中,则对碳原子成键轨道的要求是:
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原于。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是__ _
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是rcm,则铁的密度是 ___。
H |
|
|
|
|
|
| He |
1.312 0 |
|
|
|
|
|
| 0.372 3 |
Li | Be | B | C | N | O | F | Ne |
0.520 3 | 0.899 5 | 0.800 1 | 1.086 4 | 1.402 3 | 1.314 0 | 1.681 0 | 2.080 7 |
Na | Mg | Al | Si | P | S | Cl | Ar |
0.495 8 | 0.737 7 | 0.577 6 | 0.786 5 | 1.011 8 | 0.999 6 | 1.251 1 | 1.520 5 |
K | Ca | Ga | Ge | As | Se | Br | Kr |
0.418 9 | 0.589 8 | 0.578 8 | x | 0.944 0 | 0.940 9 | 1.139 9 | 1.350 7 |
Rb | Sr | In | Sn | Sb | Te | I | Xe |
0.403 0 | 0.549 5 | 0.558 3 | 0.708 6 | 0.831 6 | 0.869 3 | 1.008 4 | 1.170 4 |
Cs | Ba | Tl | Pb | Bi | Po | At | Rn |
0.376 | 0.503 | 0.589 | 0.716 | 0.703 | 0.812 | 0.912 | 1.037 |
回答下列问题:
(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是__________。说明同一主族元素从上到下__________能力逐渐增强。
(2)从表中数据预测Ge元素第一电离能x的取值范围_______________。
(3)观察第2、3周期中各元素的第一电离能,找出同一周期中元素第一电离能的变化规律。(说出一点即可)_______________。
(4)SiC是原子晶体,其结构类似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为一个正方体,其中心为Si原子,试在正方体的顶点画出与Si(用![]() 表示)最近的C(用
表示)最近的C(用![]() 表示)的位置。
表示)的位置。

H |
|
|
|
|
|
| He |
1.3120 |
|
|
|
|
|
| 0.3723 |
Li | Be | B | C | N | O | F | Ne |
0.5203 | 0.8995 | 0.8001 | 1.0864 | 1.4023 | 1.3140 | 1.6810 | 2.0807 |
Na | Mg | Al | Si | P | S | Cl | Ar |
0.4958 | 0.7377 | 0.5776 | 0.7865 | 1.0118 | 0.9996 | 1.2511 | 1.5205 |
K | Ca | Ga | Ge | As | Se | Br | Kr |
0.4189 | 0.5898 | 0.5788 | x | 0.9440 | 0.9409 | 1.1399 | 1.3507 |
Rb | Sr | In | Sn | Sb | Te | I | Xe |
0.4030 | 0.5495 | 0.5583 | 0.7086 | 0.8316 | 0.8693 | 1.0084 | 1.1704 |
Cs | Ba | Tl | Pb | Bi | Po | At | Rn |
0.376 | 0.503 | 0.589 | 0.716 | 0.703 | 0.812 | 0.912 | 1.037 |
回答下列问题。
(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是________。说明同一主族元素从上到下________能力逐渐增强。
(2)从表中数据预测Ge元素第一电离能x的取值范围________。
(3)观察第2、3周期中各元素的第一电离能,找出同一周期中元素第一电离能的变化规律。
(说出一点即可) ________。
(4)SiC是原子晶体,其结构类似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为一个正方体,其中心为Si原子,试在正方体的顶点画出与Si(用![]() 表示)最近的C(用○表示)的位置。
表示)最近的C(用○表示)的位置。

现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com