
题目列表(包括答案和解析)
(16分)铜在自然界中存在于多种矿石中,如
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 |
|
|
|
|
请回答以下问题:
(1)上表所列铜的化合物中,铜的质量分数最高的是______________(填化学式)。
(2)工业上以黄铜矿为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
![]() ,该反应的还原剂是____________;若在标准状况下放出气体56L,则转移电子的物质的量为_____________。
,该反应的还原剂是____________;若在标准状况下放出气体56L,则转移电子的物质的量为_____________。
(3)某同学采集酸雨样品并测其pH,发现在一段时间内其pH逐渐减小。请用必要的文字和化学方程式说明其原因______________________________________________
________________________________________________________。
(4)铜制品长期置于潮湿的环境中,表面会产生一层铜绿,其主要成分与孔雀石相同。
请写出采用化学方法除去铜器表面铜绿的有关反应的离子方程式:_____________
_______________________________________________。
(5)![]() 与
与![]() 都是红色粉末。
都是红色粉末。![]() 溶于稀
溶于稀![]() 会生成
会生成![]() 和
和![]() 。一同学为鉴定某
。一同学为鉴定某![]() 样品中是否混有多少量的
样品中是否混有多少量的![]() ,设计了如下实验:取少量粉末放入足量稀
,设计了如下实验:取少量粉末放入足量稀![]() 中,向所得溶液中滴加
中,向所得溶液中滴加![]() 试剂。该同学通过实验认为:若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含
试剂。该同学通过实验认为:若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含![]() 。你认为这种说法是否正确___________:简述你的理由(用离子方程式表示):______________,
。你认为这种说法是否正确___________:简述你的理由(用离子方程式表示):______________,
如果要得到准确的结论,还需加入的一种试剂是_________________。
(1)舞台上的幕布与布景多是用浓氯化铵溶液浸过制成的,可以防火。其原因是___________________________________。
(2)已知NH3分子结合H+的能力比结合Ag+的能力强。要使[Ag(NH3)2]+转化为自由的Ag+,应加入的试剂名称是_________________,实现转化的离子方程式是___________________。
(3)氮的氧化物NOx与氨气反应生成N2和H2O,写出反应的化学方程式________________。若在标准状况下1.5 L NOx与2 L NH3恰好完全作用,则NOx中x的值为______________。
(1)舞台上的幕布与布景多是用浓氯化铵溶液浸过制成的,可以防火。其原因是________。?
(2)已知NH3分子结合H+的能力比结合Ag+的能力强。要使[Ag(NH3)2]+转化为自由的Ag+,应加入的试剂名称是________。实现转化的离子方程式是________________________________。
(3)氮的氧化物NOx与氨气反应生成N2和H2O,写出反应的化学方程式________________________________,若在标准状况下1.5 LNOx与2 L NH3恰好完全作用,则NOx中x的值为_______。
高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, 。Na2O2跟水反应的化学方程式是 ,
其中还原剂是 ,氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
|
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积) (填序号),理由是 。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(选填“100mL”“200mL”“500mL”或“1000mL”)。
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂从下列固物质中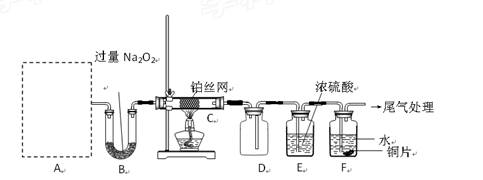
a. NH4HCO3、b. NH4Cl、c. Ca(OH)2、d. NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是________ (填备选试剂的字母);此时A中主要的玻璃仪器有________________(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:_____________________。
(3)对于C中发生的可逆反应,下列说法正确的是________。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
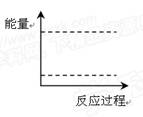
(4)请在下图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500mL1mol·L-1 盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是____mol,甲在标准状况下是_____L(忽略气体的溶解)。
一、 选择题(本题包括15小题,每小题只有一个选项符合题意,每题4分,共60分)
1 D 2. D 3. B 4. C 5. D 6. D 7.B 8. D 9. C
10 .B
二、选择题
16 AD 17 D 18D
【必做部分】
23.(12分)(1)图正确得2分
(2)电压U与电阻R的比值(或电流I)(2分):表格中各电流值分别为0.05,0.09,0.14,0.20,0.24,0.27(2分);图像如图所示(2分)
(3)2.00(1.98―2.02)(2分),0.45(0.40―0.50) (2分)

24.(15分)解:(1)运动员从最高点下落过程为平抛运动,竖直分运动为自由落体运动。设运动员起跳后重心离地的高度为H,则
 (2分)
(2分)
即 (2分)
(2分)
(2)设运动员脚刚触地时的竖直分速度为 。则由机械能守恒,
。则由机械能守恒,
 (4分)
(4分)
设运动员落地时受到的竖直方向的平均作用力为F,由动能定理得

 (4分)
(4分)
联立两式得 (3分)
(3分)
25.(18分)解:(1)粒子在第一象限做类平抛运动,
加速度 (3分)
(3分)
运动时间  (2分)
(2分)
沿 方向的位移
方向的位移
(2)粒子通过 轴进入磁场时在
轴进入磁场时在 方向上的速度
方向上的速度
 (2分)
(2分)
因此
粒子在第二象限以 为圆心做匀速圆周运动,圆弧所对的圆心角为
为圆心做匀速圆周运动,圆弧所对的圆心角为 ,运动时间
,运动时间

(3)粒子从磁场返回电场后的运动是此前由电场进入磁场运动的逆运动,经时间
粒子的速度变为 ,此后重复前面的运动。(2分)
,此后重复前面的运动。(2分)
粒子在电磁场中运动的周期 (2分)
(2分)
26. (15分)
(1)尝 X 甲病男女患者人数基本相同,乙病男性患者多余女性患者(2分) 基因突变(2)①aaXbY aaXBXb 或aaXBXb (不全不给分)
② 1/2 ③ 1/2 1/16 女
(3)增加 表兄妹之间有一部分基因相同(携带同种隐性致病基因的可能性较大)
(4)遗传咨询,产前诊断(2分)
27(18分)(1)神经-体液、免疫(2分) 含量少、作用大(2分)
(2)I 胰岛素(1分) 血糖利用、转化为糖元(2分) 非糖物质转化为血糖(肝糖元的分解)(2分)
II 反馈调节(2分)
III 细胞膜上受体蛋白不正常(或a激素不能与受体结合或控制 细胞膜上受体蛋白的基因发生突变所致)其他合理答案亦给分。(3分)
 (3)见下图,每图2分,共4分
(3)见下图,每图2分,共4分
28.(16分)
(1)Cu2S(2分) (2)Cu2S(2分)15mol(2分)
(3)酸雨中主要成分为H2SO3 :SO2-H2O=2H2SO2 (1分) H2SO3在空气中被氧化:
2H2SO3+O2=2H2SO4 (1分) 硫酸的酸性比亚硫酸强(1分)
(4)CuCO3?Cu(OH)2+4H-=2Cu2++3 H2O+CO2 (2分)
(5)否 (1分) Cu+2Fe3+= Cu2++2 Fe2+ (2分) 氯水(或双氧水) (2分)
29. (14分)
(1)0.1 (3分) (2)a (3分)
(3)①反应① (2分) Fe(OH)3+5OH-+3e-=Fe +4H2O
(3分)
+4H2O
(3分)
②强氧化性能杀菌消毒,其还原产物Fe3-水解[Fe3-+3H2O=Fe(OH)3(胶体)+3H-生成Fe(OH)3胶体能吸附水中杂质沉降而净水(3分)
30. (12分)
I (1)②(2分) (2)B (2分) (3)正确(2分)
II 从甲、乙两同学试验可以看出;
① 加热碳酸氢钠溶液至 离子水解,使溶液碱性增强(3分)
离子水解,使溶液碱性增强(3分)
② 当加热碳酸氢铵溶液至
31.略
32.(共8分)
(1)1 (1分) 2 (1分) ,三角锥形(1分)
(2)低于(1分) Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高(2分)
(3)1s22s22p63s23p64s13d5(2分)
33.(8分)

(3)氧化反应 (2分)
34. (8分) (1)
(3)胶片上的蛋白膜存在时间的长短(或其他理由答案) (4)固定化酶
(5)萃取法、蒸馏法、压榨法(只要答出2条,就得2分)
(6)平板划线法 稀释涂布平板法
35. (8分) (1)核移植技术、动物细胞培养(缺一不给分)
(2)基因文库中提取,PCR技术扩增,人工化学合成(至少答对2项才能得分)启动子、终止子、标记基因(缺一不给分) 显微注射法
(3)胰蛋白酶或胶原蛋白酶 减数第二次分裂中期
(4)桑 胚和囊胚 节约资源、降低成本等(酌情给分)
胚和囊胚 节约资源、降低成本等(酌情给分)
36. (8分)
(1)  (1分)
(1分)  (1分)
(1分)
(2)①活塞缓慢下移,理想气体温度不变,内能不变,体积减小,外界度气体做功,根据热力学第一定律知,气体放热。(2分)
②根据玻意耳定律: (2分)
(2分)
活塞移动后气体的体积为: (2分)
(2分)
37. (8分)
解:(1)传播速度  (2分)
(2分)
(2)波由波源传到J所需时间 (1分)
(1分)
波刚传到J点时,J向上运动,到负的最大位移需时 (1分)
(1分)
所以总时间为 (1分)
(1分)
(3)图3分

38. (8分)
(1) 2(1分) 质子(或 ) (1分) ;
) (1分) ; (2分)
(2分)
(2)设加速后航天器的速度大小为 ,由动量守恒定律有
,由动量守恒定律有
 (3分)
(3分)
 (1分)
(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com