
题目列表(包括答案和解析)
(14分)一定条件下铁可以和![]() 发生反应:
发生反应:![]() ,已知该反应的平衡常数(
,已知该反应的平衡常数(![]() )与温度(
)与温度(![]() )的关系如图甲所示:
)的关系如图甲所示:

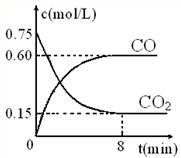
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的![]() 气体,反应过程中
气体,反应过程中
![]() 气体和
气体和![]() 气体的浓度与时间的关系如图乙所示。5min内,CO的平均反应速率
气体的浓度与时间的关系如图乙所示。5min内,CO的平均反应速率![]() =_________________mol/(L?min)。
=_________________mol/(L?min)。
(2)下列措施中能使平衡时![]() 增大的是__________(填序号)。
增大的是__________(填序号)。
a.升高温度 b.增大压强 c.充入一定量CO d.再加入一些铁粉
(3)高铁酸钠是一种强氧化剂,具有广泛的用途。
①高铁酸钠与锌组成的高铁电池,不产生污染物,电压高、电量大,是广受欢迎的新型电源,该电池反应为:![]()
![]()
![]()
![]() ,请回答:放电反应为_________(填“反应①”或“反应②”),充电时阳极电极反应式为:_____________________________________。
,请回答:放电反应为_________(填“反应①”或“反应②”),充电时阳极电极反应式为:_____________________________________。
②高铁酸钠是一种新型饮用水净水消毒剂,请简述其净水消毒原理。
 (2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,
(2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,| 1 | 2 |
 (2011?福建模拟)一定条件下铁可以和CO2发生反应:
(2011?福建模拟)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0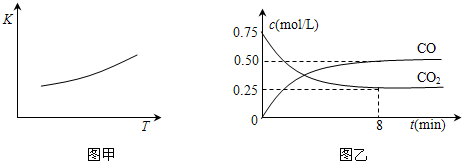
| 电解 |
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
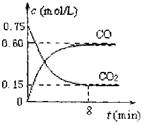
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”),该反应的平衡常数K= ,温度升高,K (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(6)已知Ksp(Fe(OH)3)= 8´10-38,某溶液中含有Fe3的浓度是0.05mol×L-1。如果要使Fe(OH)3沉淀完全pH至少为 (溶液中离子浓度小于1×10-5mol/L时,沉淀完全,lg2=0.3)
一、 选择题(本题包括15小题,每小题只有一个选项符合题意,每题4分,共60分)
1 D 2. D 3. B 4. C 5. D 6. D 7.B 8. D 9. C
10 .B
二、选择题
16 AD 17 D 18D
【必做部分】
23.(12分)(1)图正确得2分
(2)电压U与电阻R的比值(或电流I)(2分):表格中各电流值分别为0.05,0.09,0.14,0.20,0.24,0.27(2分);图像如图所示(2分)
(3)2.00(1.98―2.02)(2分),0.45(0.40―0.50) (2分)

24.(15分)解:(1)运动员从最高点下落过程为平抛运动,竖直分运动为自由落体运动。设运动员起跳后重心离地的高度为H,则
 (2分)
(2分)
即 (2分)
(2分)
(2)设运动员脚刚触地时的竖直分速度为 。则由机械能守恒,
。则由机械能守恒,
 (4分)
(4分)
设运动员落地时受到的竖直方向的平均作用力为F,由动能定理得

 (4分)
(4分)
联立两式得 (3分)
(3分)
25.(18分)解:(1)粒子在第一象限做类平抛运动,
加速度 (3分)
(3分)
运动时间  (2分)
(2分)
沿 方向的位移
方向的位移
(2)粒子通过 轴进入磁场时在
轴进入磁场时在 方向上的速度
方向上的速度
 (2分)
(2分)
因此
粒子在第二象限以 为圆心做匀速圆周运动,圆弧所对的圆心角为
为圆心做匀速圆周运动,圆弧所对的圆心角为 ,运动时间
,运动时间

(3)粒子从磁场返回电场后的运动是此前由电场进入磁场运动的逆运动,经时间
粒子的速度变为 ,此后重复前面的运动。(2分)
,此后重复前面的运动。(2分)
粒子在电磁场中运动的周期 (2分)
(2分)
26. (15分)
(1)尝 X 甲病男女患者人数基本相同,乙病男性患者多余女性患者(2分) 基因突变(2)①aaXbY aaXBXb 或aaXBXb (不全不给分)
② 1/2 ③ 1/2 1/16 女
(3)增加 表兄妹之间有一部分基因相同(携带同种隐性致病基因的可能性较大)
(4)遗传咨询,产前诊断(2分)
27(18分)(1)神经-体液、免疫(2分) 含量少、作用大(2分)
(2)I 胰岛素(1分) 血糖利用、转化为糖元(2分) 非糖物质转化为血糖(肝糖元的分解)(2分)
II 反馈调节(2分)
III 细胞膜上受体蛋白不正常(或a激素不能与受体结合或控制 细胞膜上受体蛋白的基因发生突变所致)其他合理答案亦给分。(3分)
 (3)见下图,每图2分,共4分
(3)见下图,每图2分,共4分
28.(16分)
(1)Cu2S(2分) (2)Cu2S(2分)15mol(2分)
(3)酸雨中主要成分为H2SO3 :SO2-H2O=2H2SO2 (1分) H2SO3在空气中被氧化:
2H2SO3+O2=2H2SO4 (1分) 硫酸的酸性比亚硫酸强(1分)
(4)CuCO3?Cu(OH)2+4H-=2Cu2++3 H2O+CO2 (2分)
(5)否 (1分) Cu+2Fe3+= Cu2++2 Fe2+ (2分) 氯水(或双氧水) (2分)
29. (14分)
(1)0.1 (3分) (2)a (3分)
(3)①反应① (2分) Fe(OH)3+5OH-+3e-=Fe +4H2O
(3分)
+4H2O
(3分)
②强氧化性能杀菌消毒,其还原产物Fe3-水解[Fe3-+3H2O=Fe(OH)3(胶体)+3H-生成Fe(OH)3胶体能吸附水中杂质沉降而净水(3分)
30. (12分)
I (1)②(2分) (2)B (2分) (3)正确(2分)
II 从甲、乙两同学试验可以看出;
① 加热碳酸氢钠溶液至 离子水解,使溶液碱性增强(3分)
离子水解,使溶液碱性增强(3分)
② 当加热碳酸氢铵溶液至
31.略
32.(共8分)
(1)1 (1分) 2 (1分) ,三角锥形(1分)
(2)低于(1分) Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高(2分)
(3)1s22s22p63s23p64s13d5(2分)
33.(8分)

(3)氧化反应 (2分)
34. (8分) (1)
(3)胶片上的蛋白膜存在时间的长短(或其他理由答案) (4)固定化酶
(5)萃取法、蒸馏法、压榨法(只要答出2条,就得2分)
(6)平板划线法 稀释涂布平板法
35. (8分) (1)核移植技术、动物细胞培养(缺一不给分)
(2)基因文库中提取,PCR技术扩增,人工化学合成(至少答对2项才能得分)启动子、终止子、标记基因(缺一不给分) 显微注射法
(3)胰蛋白酶或胶原蛋白酶 减数第二次分裂中期
(4)桑 胚和囊胚 节约资源、降低成本等(酌情给分)
胚和囊胚 节约资源、降低成本等(酌情给分)
36. (8分)
(1)  (1分)
(1分)  (1分)
(1分)
(2)①活塞缓慢下移,理想气体温度不变,内能不变,体积减小,外界度气体做功,根据热力学第一定律知,气体放热。(2分)
②根据玻意耳定律: (2分)
(2分)
活塞移动后气体的体积为: (2分)
(2分)
37. (8分)
解:(1)传播速度  (2分)
(2分)
(2)波由波源传到J所需时间 (1分)
(1分)
波刚传到J点时,J向上运动,到负的最大位移需时 (1分)
(1分)
所以总时间为 (1分)
(1分)
(3)图3分

38. (8分)
(1) 2(1分) 质子(或 ) (1分) ;
) (1分) ; (2分)
(2分)
(2)设加速后航天器的速度大小为 ,由动量守恒定律有
,由动量守恒定律有
 (3分)
(3分)
 (1分)
(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com